司美格鲁肽治疗外周动脉疾病III期研究成功,IcoSema已申报上市
11月6日,诺和诺德发布2024Q3财报,其中披露几个重要信息:1)已顺利完成司美格鲁肽1.0mg治疗外周动脉疾病(PAD)的IIIb期STRIDE研究,并将于2025年上半年向欧美申请新适应症拓展;2)已向欧盟递交IcoSema(Icodec依柯胰岛素+司美格鲁肽,每周1次)用于治疗2型糖尿病(T2D)的上市申请;3)基于IIIb期FRONTIER 5研究的成功,诺和诺德预计将于2025年向监管机构提交Mim8的首次上市申请。
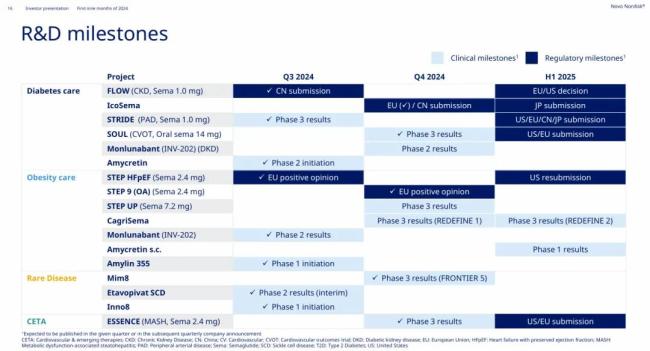
具体来看,9月,诺和诺德成功完成了为期52周的IIIb期STRIDE研究,该研究旨在探索司美格鲁肽对比安慰剂作为标准疗法的辅助药物治疗PAD合并T2D患者的功能结局影响。下肢PAD由腿部动脉粥样硬化引起,可能导致重度功能障碍,而T2D患者发生PAD的风险高于非T2D患者。

研究达到了主要终点,即与安慰剂组相比,司美格鲁肽组患者在最大步行距离方面有13%的明显改善,且具有统计学意义和临床相关性。与安慰剂组的8%(基线:186米)相比,司美格鲁肽组最大步行距离增加了21%(基线:185米)。诺和诺德预计将于2025年上半年向美国和欧盟的监管机构申请批准司美格鲁肽的适应症扩展。10月,诺和诺德向欧盟递交了复方制剂IcoSema(Icodec依柯胰岛素+司美格鲁肽,每周1次)用于治疗T2D的上市申请。

早在今年1月,诺和诺德就宣布了IcoSema vs 基础胰岛素治疗T2D的IIIa期COMBINE 3研究达到主要终点。在总体基线HbA1c为8.30%的情况下,IcoSema组的估计HbA1c降幅为-1.47%,而甘精胰岛素U100和门冬胰岛素组的估计HbA1c降幅为-1.40(估计治疗差异:-0.06%)。
10月,诺和诺德还顺利完成了一项开放标签的IIIb期FRONTIER 5研究,研究对象是伴或不伴抑制物的成人和青少年A型血友病患者。

这项为期26周的试验旨在评估从艾美赛珠单抗预防治疗转为Mim8预防治疗的安全性。在试验中,从艾美赛珠单抗治疗转为Mim8治疗的耐受性良好。此外,研究参与者非常喜欢Mim8装置,并表示Mim8笔式注射器易于使用。在与监管机构进行互动后,诺和诺德目前预计将在2025年提交Mim8的首次批准申请。值得一提的是,Mim8的IIIa期FRONTIER 2研究也在今年5月传来捷报。该研究评估了每周1次Mim8和每月1次Mim8预防治疗伴或不伴抑制物的青少年和成人血友病A患者的疗效和安全性。结果显示,在既往未接受过预防治疗的血友病A患者中,与未接受预防治疗的患者组相比,每周1次Mim8组和每月1次Mim8组患者的治疗出血次数分别降低了97%和99%。
推荐阅读
口服司美格鲁肽25mg减重III期研究成功
诺和诺德在公布2024年H1业绩时透露,口服司美格鲁肽Rybelsus(25mg)的减重III期OASIS 4研究已成功完成。
重磅!最火的减肥针来了!司美格鲁肽减重适应症国内获批,国内还有哪些核心玩家?
首个用于长期体重管理的GLP-1RA周制剂诺和盈®在中国获批了,这也意味着减重市场最大的参与者诺和诺德开始了新一轮“攻城略池”行动。
司美格鲁肽国内药企竞速!丽珠BLA上市获受理,九源基因/华东医药能否率先冲线?
在健康需求增强和市场激增的影响下,司美格鲁肽在全球持续大卖,国内市场的参与者也开始全力冲刺。
礼来史上最大一笔投资!90亿美元自建工厂生产替尔泊肽
5月24日,礼来宣布追加53亿美元以扩大其在美国印第安纳州黎巴嫩生产基地的产能,用于生产替尔泊肽的活性药物成分。
“减肥神药”国内获批,号称体重能降17%!有人称用后腹泻、头晕…或致阳痿?
该文章指出,接受司美格鲁肽处方的非糖尿病男性更容易出现勃起功能障碍(阳痿,ED)。
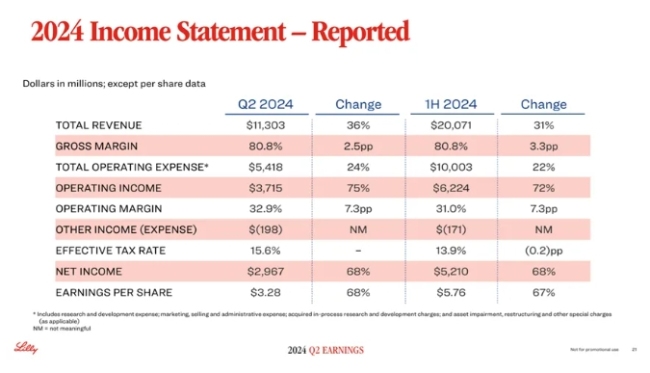
礼来2024H1:总营收同比增长31%,替尔泊肽收入超66亿美元,申报新适应症上市
礼来公布了2024上半年财报,全球收入200.71亿美元,同比增长31%。
通化东宝补齐GLP-1拼图!押宝消费医疗领域能否重回高速增长曲线?
面对营收增长放缓与利润持续下滑的挑战,加快转型和寻找新的利润增长点成为药企在战略上的必然选择。
北京飞大连只要199元!航司开打“价格战”,多条航线票价低至2折
航旅纵横大数据显示,10月中下旬,北京—西安、北京—成都、上海—海口、上海—广州等多条热门航线,均有低至2折的机票在售。