盘点:我国儿童用中药新药审批进展
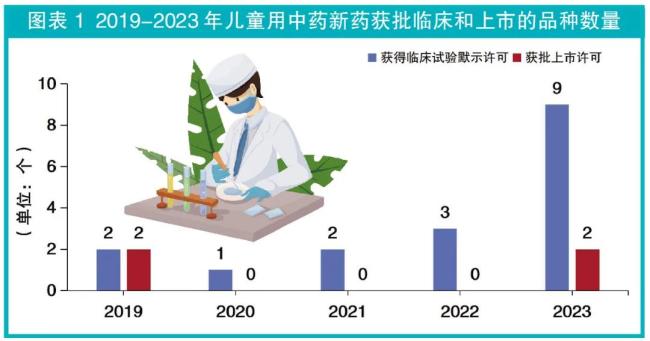
近5年来,我国儿童用中药新药研发取得了一定进展,虽然儿童用中药新药获批上市许可和获得临床试验默示许可的数量总体较少(详见图表1),但获得临床试验默示许可的数量逐年增加。
新药研发周期较长
2019-2023年,国家药监局批准上市许可的33个中药新药(含中药1-3类,原中药1-8类)品种中,仅4个品种明确可用于儿童群体(详见图表2),占总数的12.1%(4个/33个),包括中药创新药3个,中药改良型新药1个。
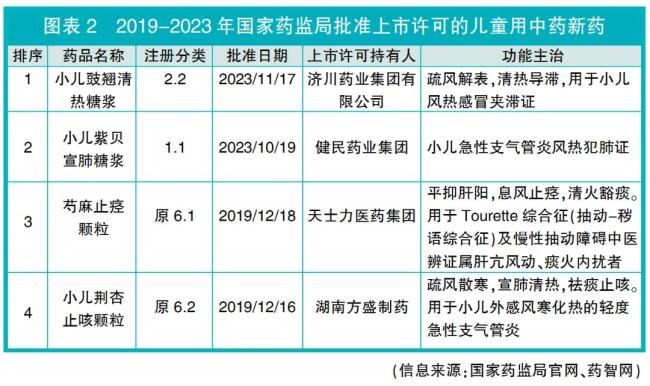
获批上市许可的4个儿童用中药新药适应症领域,除芍麻止痉颗粒为精神神经药品外,其他3个适应症领域为呼吸类,其中小儿紫贝宣肺糖浆、小儿荆杏止咳颗粒2个品种的功能主治中,均明确用于小儿急性支气管炎。急性气管炎/支气管炎属于中医学“咳嗽”范畴,当前指南推荐的药物治疗以对症治疗为主,是中医药治疗的优势病种。
获批上市许可的4个儿童用中药新药中有3个中药创新药,据国家药品监督管理局药品审评中心(CDE)公开的申请上市技术审评报告,这3个中药创新药均为中药复方制剂,来源于临床经验方,研发周期长,获批进行临床试验至获批上市许可时间逾十年,且在申请新药上市许可前均完成了随机、双盲、平行对照、多中心的Ⅱ期和Ⅲ期临床试验。
适应症领域集中
据CDE公开信息,按照“儿童”“小儿”等关键词检索药品名称以及获得临床试验默示许可时公开的功能主治,2019-2023年共有17个儿童用中药新药品种获得临床试验默示许可(详见图表3),含11个中药创新药和6个中药改良型新药(改变剂型3个、增加功能主治2个、既改变剂型又增加功能主治1个)。
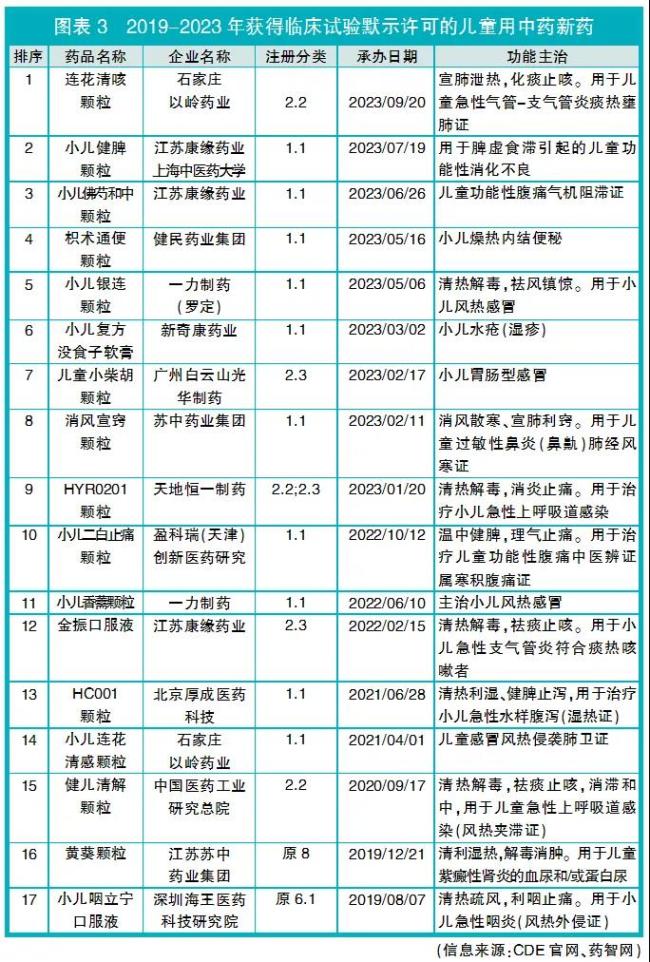
笔者查询相关公司新闻报道发现,7个儿童用中药创新药品种(小儿健脾颗粒、小儿佛芍和中颗粒、枳术通便颗粒、消风宣窍颗粒、小儿二白止痛颗粒、HC001颗粒、小儿咽立宁口服液)来自临床经验方。
在获得临床试验默示许可的17个儿童用中药新药品种中,8个品种(小儿连花清感颗粒、HC001颗粒、小儿香薷颗粒、消风宣窍颗粒、HYR0201颗粒、金振口服液、健儿清解颗粒、黄葵颗粒)已在CDE药物临床试验登记与信息公示平台进行了临床试验登记,其中进展最快的是石家庄以岭药业的小儿连花清感颗粒,正在进行Ⅲ期临床试验。
获得临床试验默示许可的儿童用中药新药剂型以颗粒剂为主,占82.4%(14个/17个);适应症领域分布集中,呼吸和消化2个领域的药物占主流,占比为88.2%(15个/17个)。
研发指导原则发布
儿童可用的中药品种数量占比较少,天津中医药大学附属第一医院的研究人员以“宝”“岁”“儿”等为检索词,在“药品名称”“功能主治”“用法与用量”“限定”字段进行检索后发现,《中国药典》(2020年版及第一增补本)中收载的儿童用中药成方制剂和单味制剂仅占总量的15.4%(248种/1615种)、《国家基本药物目录》(2018年版)中儿童用中成药仅占总量的12.6%(59种/268种)。
总体来看,2019-2023年获批上市许可和获得临床试验默示许可的儿童用中药新药品种数同样较少,分别占中药新药总数的12.1%(4个/33个)和9.7%(17个/174个)。
儿童用中药新药的研发多源于临床经验方,剂型的选择以儿童生理特征、方便调整用量为原则,颗粒剂为主,也有口服溶液剂、糖浆剂和软膏剂。且这类药品的注册申请易于纳入优先审评审批程序(符合儿童生理特征的儿童用药品新品种、剂型和规格)。
为进一步完善“中医药理论、人用经验和临床试验相结合的中药注册审评证据体系”,充分发挥中医药在儿童疾病方面的优势作用,鼓励儿童用中药研发,2月29日,CDE发布了第一个针对儿童群体的中药新药研发指导原则《小儿便秘中药新药临床研发技术指导原则(试行)》。相信随着CDE针对儿童群体的中药新药研发指导原则陆续发布,企业将更积极、科学、规范地开展儿童用中药新药的研发。
“三结合”降低研发成本
3月1日,在征求意见稿发布时隔4个多月后,国家药监局药审中心正式发布《小儿便秘中药新药临床研发技术指导原则(试行)》(以下简称《指导原则》试行稿)。
《指导原则》试行稿系统阐述了小儿便秘的中医药理论特点,提出了人用经验收集整理需重点关注的内容,明确了中药新药可能的临床定位,强调了中医药理论和人用经验对小儿便秘中药新药研发的支持作用,并对临床研发总体考虑、临床试验设计和评价需关注的问题等提出了相关建议。
可操作性增强
《指导原则》试行稿与征求意见稿的内容基本一致,仅对征求意见稿的部分内容描述进行删除、新增或顺序调整,使全文用词更精准、更简洁、更通顺,可操作性更强。如《指导原则》试行稿新增了两处临床评价新工具,概述部分新增“观察者/监护者报告结局”作为临床报告结局指标;次要疗效指标对于疼痛的评价部分新增“视觉模拟量表(VAS)评分、数字评定量表(NRS)评分”。对于目标人群描述部分则删除了“原则上,应当先在较大年龄段儿童中获得初步的有效性和安全性信息后,再开展较小年龄段人群的临床研究。”
驱动研发创新
长期以来,我国儿科中药研发较为滞后,适宜品种、剂型、规格开发相对不足。随着国家陆续出台多项利好政策,合力驱动儿科药创新研发成为趋势。
2020-2023年,我国儿童用中药新药分别有2个药获批上市及15个药获批临床试验默示许可,上市创新药涉及健民集团1.1类中药创新药小儿紫贝宣肺糖浆及济川药业2类中药改良型新药小儿豉翘清热糖浆。从儿科用药剂型来看,目前在研的儿科中药新药以颗粒剂、口服液、合剂等适宜儿童的剂型为主,适应症以感冒、支气管炎、腹泻等儿科常见病居多,缺乏儿童罕见病、危重症、早产儿或新生儿疾病治疗的专用中药。
机遇挑战并存
近10年,为了鼓励国内药企加大对儿科中药的研发和生产,相关部门陆续出台系列指导原则、鼓励研发药品清单、优先评审等相关政策,为中药企业带来了新的研发机遇。特别是“三结合”审评证据体系的构建,对于传统中药给药途径和工艺的新药,符合中医药理论、具有人用经验支持的中药复方制剂,可鼓励使用人用经验数据、真实世界研究用于儿童药研发,并作为支持注册的证据之一,以减少不必要的儿童人群临床试验,有效降低儿童药品的研发成本,提高研发效率,提高药品生产企业或相应机构的研发积极性。
然而,与化药相比,从事中药新药研发的团队比较少,限制了中药在儿童用药领域的创新与发展。同时,受儿童体质和疾病与成人差异较大、伦理和临床试验有难度、研发周期长、投入成本多、上市风险高、收益不成正比等因素影响,企业在儿科用药研发方面的动力稍嫌不足。
研发有的放矢
米内网数据显示,2023年上半年,在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院终端,中药儿科用药销售额超过52亿元,增长率达10.36%,中国城市实体药店终端儿科中成药销售额同比涨幅15.12%,市场潜力持续爆发。企业研发儿科中药不妨从以下三个方向着手:
一是,筛选中医药优势病种,开发适合儿科用中药。
可考虑以古代经典名方、名老中医经验方为基础,将中医辨证与现代中医辨病相结合,以期研发出疗效好、不良反应少、服用方便、价格经济的儿科治疗用药。
二是,开展儿童用药临床试验,完善儿童用药剂量。
可通过注册申请等方式开展规范的儿童用药临床试验,获取儿童的人用经验或探索真实世界研究数据,明确具体的儿童用法用量和疗程,通过变更剂型、规格等方式,研发适宜不同年龄段儿童使用的剂型、规格,尤其是适合低龄儿童的剂型,如口服液、滴剂等,将成人、儿童共用药扩展至儿童用药。
三是,重视市场需求调研,专研儿科专用中药。
基于儿科疾病用药的需求迫切性,在充分考虑儿科人群病症的流行率、待治疗疾病(或证候)的严重性、替代药物是否缺乏、临床是否急需等情况的基础上,精准对标具体的治疗需求,优选合理的方药、剂型开展儿童罕见病等研究,使儿科专用中药的研发有的放矢。
推荐阅读
恒安众生闪耀中药配方颗粒市场峰会,展现新动力
12月5日,由赛柏蓝、中药配方颗粒行业联盟主办,北京恒安众生科技有限公司协办的第2届中药配方颗粒市场峰会在广州东方宾馆隆重召开。
聚焦中药大健康,瘦身强体后康恩贝能否走出低谷?
回溯其发展历史,不难发现康恩贝2019年至2022年之间的业绩起伏极大。不过,调整发展战略之后,将重心聚焦于中药大健康领域,康恩贝似乎看到了走出低谷的曙光。
斥资156亿,国药集团大动作
中国中药拟私有化退市,溢价约34.11%2月21日,中国中药正式宣布,其控股股东国药集团拟以每股4.6港元的价格将中国中药控股私有化。
默沙东2.08亿美元收购一家初创公司
近日,默沙东收购了初创公司Abceutics,这是一家从纽约州立大学布法罗分校(简称UB)研究员Joseph P. Balthasar博士的实验室分离出来的生物制药公司。
Ionis公布反义寡核苷酸新药III期研究完整数据
4月7日,Ionis Pharmaceuticals公布了Olezarsen治疗家族性高乳糜微粒血症综合征(FCS)的III期Balance研究全部结果。
BD解决了3年现金流问题,但投资人退出怎么办?
今年3月15日,刚刚在易贸生物产业大会策划组织了一场“你准备好做BD了吗”的panel,3月20日,包骏博士又作为同写意BD俱乐部的理事长,赶到泰州参加了为期两天的BD培训会。
百济独占鳌头,君实肾癌破局,汉霖、乐普成黑马?
随着年报的披露,国内各家药企也交出了自家PD-1产品在2023年的成绩单,这一极度内卷的赛道如今已迎来到新的竞争局面。
刚刚!国内仿制药龙头与BI达成合作
2024年4月8日,中国生物制药有限公司(以下简称中国生物制药)在港交所发布公告显示,该公司已与勃林格殷格翰达成合作,将勃林格殷格翰的创新抗肿瘤疗法带到中国市场。
小林制药“红曲事件”升级,日本首相回应……
我国营养健康市场就像一座空中楼阁,缺乏科学技术、政策法规和营商环境的有力支撑,须各界有识之士潜心研究、聚力解决!