印度药企集采药被“拉黑”,已不是第一次出质量问题

8月30日,国家医保局发布公告称,印度瑞迪博士实验室的盐酸托莫西汀胶囊在原料药、工艺验证、质量控制等方面存在缺陷,不符合中国药品生产质量管理规范的要求,国家药监局对该产品采取暂停进口、销售和使用措施。
进口仿制药参与集采热情很高,但存在的质量问题值得主管部门深入调查。
盐酸托莫西汀胶囊用于治疗儿童和青少年的注意缺陷/多动障碍。2023年11月,该药被纳入第九批全国药品集采。印度瑞迪博士实验室的产品以每盒31.5元中选,规格为25mg*30粒,供应北京,河北,山西,江苏,山东,湖北,重庆,甘肃,青海。
国家医保局暂停了瑞迪博士实验室参与国家集采的资质,自今年8月30日至2026年2月28日,与此前类似事件处罚结论相当。根据国家集采的相关规定,国家联采办已启动替补程序。
瑞迪博士实验室是印度排名第三的仿制药企业,全球排名也在前十之列。值得一提的是,此前印度排名第一的仿制药企业太阳制药也因药品质量问题,被我国取消集采中选资格。
低价抢市场,倒在质量线上
盐酸托莫西汀是第一个被FDA批准用于治疗多动症的药物,礼来公司的原研产品2002年7月在美国上市销售,核心专利于2017年5月到期。但原研药2016年才进入中国市场,所以在中国基本是原研药和仿制药同台竞争的局面。
去年,国家医保局宣布盐酸托莫西汀进入第九批国家集采,当时业内就认为它会是那批国采竞争最激烈的品种之一。
在2023年11月第九批国采的报价现场,印度瑞迪博士实验室报出远比国产药品还低的价格。现场纷纷议论:印度企业如何覆盖成本?
瑞迪博士实验室其实很早就参与中国药品集采的工作。早在4+7扩围阶段,瑞迪博士实验室的奥氮平片就是中选品种,获得大量中国市场的订单,销售量增长迅猛。公司时任首席执行官公开表示,利用全国药品集采的利好政策,努力将中国市场打造成主要增长驱动力。
尝到集采甜头的瑞迪博士实验室希望再次利用低价策略,扩大中国市场份额。但中国国家药监局的跨境飞行检查发现了这家公司的问题:瑞迪博士实验室的盐酸托莫西汀胶囊原料药不符合中国注册的要求,工艺验证、质量控制等方面存在缺陷,该产品的生产质量管理不符合要求,从即日起暂停进口、销售和使用。
这已经不是瑞迪博士实验室第一次发生产品质量问题。2018年4月,国家药监局公告,瑞迪博士实验室的富马酸喹硫平现行生产工艺、生产场地、批量与注册批准内容不一致,不符合中国药品生产质量管理规范的要求,暂停该产品在中国销售。直到2023年6月才恢复,当时富马酸喹硫平早已被纳入第三批国采,瑞迪博士实验室错失机会。
一而再、再而三出现产品质量问题,瑞迪博士实验室依然还在全球十大仿制药企之列。2023年,这家公司实现总收入32.85亿美元,美国市场业务占比达到47%,其次为印度和新兴市场的仿制药业务,分别占比17%-18%。
这次盐酸托莫西汀停售之后,国家医保局将启动备选程序。值得一提的是,由于全国药品集采的价格竞争,礼来的原研产品已于2024年1月在中国停止供应。
印度药企多次出问题,监管“零容忍”
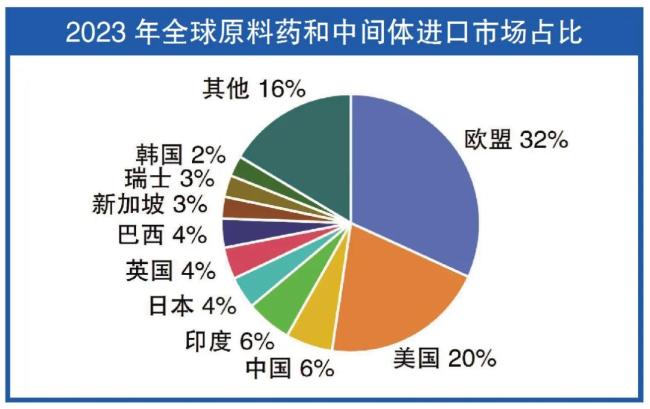
印度是全球最大的仿制药生产国,但数据造假、管理粗放、成本压缩等问题长期未能解决。
健识局梳理发现,2018年,印度素帕医药保健有限公司的盐酸氨溴索、印度太阳药业有限公司的注射用亚胺培南西司他丁钠都曾被中国国家药监局的飞检发现质量问题,而被暂停销售。
近年,国家药监局组织了多轮跨境飞检,几乎每次都能查出问题,相对而言,国内药品飞检出现问题的现象并不突出,而国外药品生产质量问题也一点都不少。
国家医保局多次公开表态:全国药品集采将引导企业的竞争焦点从拼关系、拼营销逐渐扭转至拼质量、拼效率,营造风清气正的环境,助推产业高质量发展。集采药品尽管价格低,但质量安全是生命线,国内企业大多形成了这样的意识,因此大部分集采药品的质量是有保障的。
随着国家药品集采进入常态化,医保、药监、卫健等部门的联动机制更加成熟,全面落实药品质量安全、挂网价格以及临床使用等诸多问题,努力服务好药品集采工作和“三医联动”协同发展大局。
中国药品、器械、耗材的检查水平逐渐向国际接轨。一些落后于中国标准的外资产品将逐渐被淘汰,无法通过监管部门的审核,无法登陆中国市场。
推荐阅读
吉林敖东“炒股”,荒了医药主业
近年来,上市公司“不务正业”投入巨资炒股致亏的情况屡屡发生,这也导致了云南白药在内的多家公司宣布停止“炒股”。
创新、定价、MAH,“两会”医药代表在关注什么?
2023年,中国医药行业仍处于资本下行周期,严峻的形势,对价值创造的可持续性提出挑战,行业发展亟需政策引导。
裁员互撕,2024年,医药人“倒霉让人心疼”
2022年,生物医药行业露了下行的苗头;2023年,裁员潮开始;2024年,下行不但没有结束,还有了愈演愈烈的意思。