制药巨头双抗业务版图:罗氏领跑,强生三面进击,阿斯利康“双子星”蓄力
ADC热潮之后,很多制药巨头在布局前沿技术赛道时瞄准了一个共同的方向——双抗。
根据医药魔方数据库,2024年前9个月,全球药企围绕双抗药物达成了31笔交易,数量上比之前三年的每一年都要多。
这其中也不乏制药巨头的重量级押注。8月,默沙东以7亿美元的首付款将同润生物一款处于I期阶段的CD3/CD19双抗CN201收入囊中。7月,诺华与Dren Bio就髓系细胞募集双抗的开发达成合作,交易总额达30亿美元。
与此同时,一些药企也在加快双抗药物的临床开发布局。比如阿斯利康在今年接连启动了TIGIT/PD-1双抗rilvegostomig的4项注册性临床试验,包括联合化疗对比K药的III期头对头研究。
更早下注的玩家已经步入收获。比如,罗氏的眼科双抗法瑞西单抗已成为其业绩增长的核心驱动,上市第2年的销售额便轻松突破25亿美元。强生的埃万妥单抗则在研发端实现了重要突破,联合兰泽替尼头对头击败奥希替尼,并借此拓展了新适应症。
本文对制药巨头的双抗产品管线进行梳理,并对管线较丰富的几家企业进行分析,揭示它们不同的布局重点与扩张策略。
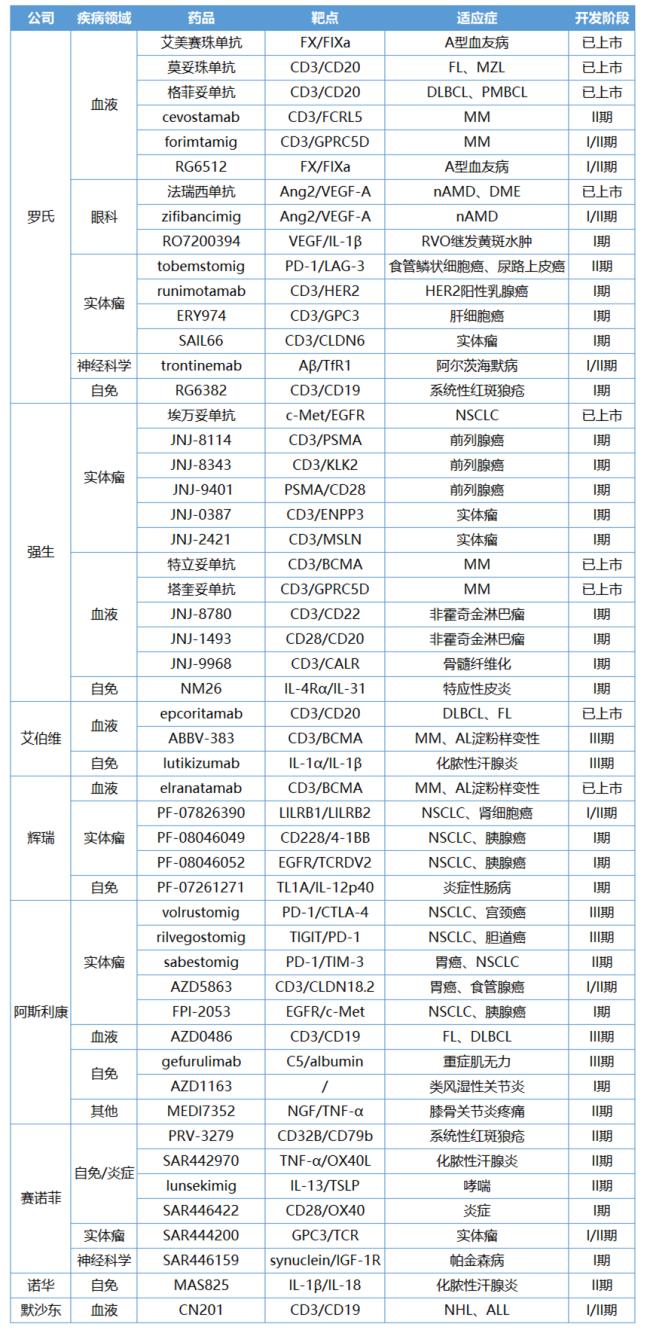
制药巨头双抗产品及临床管线
罗氏:打造畅销产品,站上赛道制高点
在双抗赛道,罗氏已展现王者风采,强大的已上市产品阵容就是其实力的最好印照。根据医药魔方数据库,全球共有15款双抗获批上市,罗氏独占4款,与Genmab并列为全球拥有最多上市双抗产品的药企。不仅仅是数量上的领先,这些产品的商业化成绩亦斐然。立足于已有产品,罗氏徐徐铺开布局版图。
艾美赛珠单抗是首个非凝血因子类血友病药物,可每4周皮下给药一次。它巧妙地利用双抗的作用模式,同时结合凝血因子IXa(FIXa)和FX来模拟FVIII的凝血功能。凭借创新性与变革性治疗价值,艾美赛珠单抗逐步“征服”广大患者,销售额一路攀升,2024上半年创收21.43亿瑞士法郎(约合24.21亿美元),是全球销售额最高的双抗药物。
新一代FX/FIXa双抗RG6512也已推进至I/II期临床阶段,其与FIX和FX形成三元复合物的能力显著优于艾美赛珠单抗,有望以更低的剂量和更长的给药间隔实现突破。继罗氏之后,诺和诺德也看好血友病双抗的开发前景。Mim8的III期研究已传来捷报,预计年内申报上市。
在血液疾病领域,罗氏还先后推出了两款CD3/CD20双抗莫妥珠单抗和格菲妥单抗,形成差异化布局。莫妥珠单抗被设计成典型的1:1结构,疗效相对温和,更适用于惰性淋巴瘤,而格菲妥单抗具有2:1比例的CD20与CD3结合位点,对表达CD20的恶性B细胞产生更强的靶向作用,可以攻克侵袭性和难治淋巴瘤。
除淋巴瘤外,罗氏还希望借力双抗打破多发性骨髓瘤(MM)的现有格局。针对发病率第二高的血液肿瘤,与多数企业押注CD3/BCMA双抗不同,罗氏主要将希望寄托于FCRH5/CD3双抗cevostamab和GPRC5D/CD3双抗forimtamig。I/II期CAMMA2研究显示,cevostamab针对三重难治性MM患者的总缓解率(ORR)为67%。
法瑞西单抗是当下罗氏增长势头最强劲的双抗产品。今年上半年,法瑞西单抗销售收入几近翻倍,达17.94亿瑞士法郎(+93%,约20.27亿美元),未来销售峰值或将超越巅峰时期的阿柏西普。
法瑞西单抗的成功不是偶然,这依赖于罗氏在眼科赛道的深厚底蕴,此前罗氏已打造出全球首个应用于眼科的抗血管内皮生长因子(VEGF)药物雷珠单抗。法瑞西单抗同时靶向VEGF-A和血管生成素2(Ang-2)两条不同的信号通路,获批了湿性年龄相关性黄斑变性(wAMD)、糖尿病黄斑水肿(DME)和视网膜静脉阻塞(RVO)继发黄斑水肿三大适应症。与单纯抗VEGF疗法相比,法瑞西单抗显著减少了眼部注射给药频率,只需每4个月给药1次。
眼科赛道,罗氏继续向着“进一步提高护理标准”的战略目标前进。两款靶向VEGF的双抗应运而生。下一代Ang2/VEGF-A双抗zifibancimig采用港式给药系统(PDS)尝试进一步延长nAMD治疗间隔;VEGF/IL-1β双抗经玻璃体内给药,用于治疗RVO继发黄斑水肿。
罗氏在实体瘤领域推进最快的双抗是靶向PD-1/LAG-3的tobemstomig,处于II期临床阶段。PD-1与LAG-3的协同作用已经得到充分验证,BMS的双免疗法Opdualag于2022年3月获批上市。围绕tobemstomig,罗氏重点开启了一项单药或联合TIGIT单抗tiragolumab一线治疗尿路上皮癌的注册性临床(NCT05645692)。
另有三款CD3双抗夯实罗氏在实体瘤领域的布局。CD3/HER2靶向的runimotamab主攻乳腺癌和胃癌;CD3/GPC3靶向的ERY974在探索治疗肝细胞癌的可行性;CD3/CLDN6靶向的SAIL66具备FIC潜质,CLDN6靶点尚未成药,其开发过程必定充满挑战,今年7月安进已终止开发同靶点双抗AMG 794。
双抗的身影也出现在罗氏的神经科学布局中。Aβ/TfR靶向的trontinemab是罗氏在阿尔茨海默病领域的一次大胆创新。
从作用机制上,trontinemab就体现出了与众不同之处,它运用罗氏大脑穿梭技术(brainshuttle),将靶向Aβ的单抗(gantenerumab)与可以和转铁蛋白受体1(TfR1)相结合的蛋白域融合,通过TfR1介导的胞吞转运有效协助抗体穿越血脑屏障。早期临床数据显示,与标准Aβ单抗相比,trontinemab能以相对较低的剂量(1.8和3.6mg/kg)快速且稳健地减少淀粉样蛋白斑块。
手握如此丰富的产品管线,罗氏已率先占据双抗赛道的竞争高地。在不断地开疆拓土中,罗氏还将继续扩大优势。
强生:血液肿瘤、实体瘤、自免全面出击
近几年,强生以每年推出1款产品的速度在双抗赛道强势崛起。2021年5月,全球首款c-Met/EGFR双抗埃万妥单抗在美获批EGFR外显子20插入突变非小细胞肺癌(NSCLC)适应症,其只需5分钟给药的皮下剂型也已申报上市。
埃万妥单抗正在抢占奥希替尼的市场份额,后者2024上半年销售额达32亿美元。MARIPOSA研究中,埃万妥单抗联合兰泽替尼头对头击败奥希替尼,显示出一线治疗EGFR外显子19缺失或外显子21L858R置换突变NSCLC的PFS获益。MARIPOSA-2研究则聚焦奥希替尼耐药后的未满足需求。凭借这两项研究,埃万妥单抗接连拓展了2项新适应症。
2022年8月,全球首款CD3/BCMA双抗特立妥单抗首次在欧盟获批上市;一年后,全球首款CD3/GPRC5D双抗塔奎妥单抗也问世了。这两款双抗是强生统治MM业务的重要接力产品。
在MM领域,强生早已建立了霸主地位,从FIC蛋白酶体抑制剂硼替佐米到全球首款CD38单抗达雷妥尤单抗,再到BCMA CAR-T西达基奥仑赛和双抗,产品护城河深厚,持续引领着MM治疗手段的演变。MM这块大蛋糕也有很多玩家竞争,仅双抗这一类型药物的相关管线就达到65项,辉瑞的CD3/BCMA双抗elranatamab已经获批上市。
对于后续的双抗药物储备,强生着重开辟实体瘤,前列腺癌是强生下一个进攻方向。靶向CD3/PSMA的JNJ-8114、靶向CD3/KLK2的JNJ-8343、靶向PSMA/CD28的JNJ-9401都已进入临床阶段。
不过JNJ-8114的一项I期研究(NCT05441501)在今年3月刚刚完成,但却已消失在强生2024Q1的管线图中。此前,强生还放弃了另一款治疗前列腺癌的CD3/TMEFF2双抗管线JNJ-8902。
JNJ-8343建立在强生和Zymeworks 2017年的合作基础上。交易背后,强生看中了Zymeworks的Azymetric和EFECT平台,其中Azymetric平台通过对IgG样抗体的重链和轻链进行专有的氨基酸修饰,从而实现单抗到多抗的转换。
JNJ-9401同样诞生于合作模式。2021年10月,强生与Xencor就CD3/CD20双抗plamotamab和CD28双抗达成一笔超13亿美元的交易。不过并不是所有交易都能走到最后。今年6月,强生已经退回了plamotamab的全球权益。至于CD28双抗的开发,除JNJ-9401外,还延伸出了CD28/CD20双抗JNJ-1493这一产品,剑指非霍奇金淋巴瘤(NHL)领域。
靶向CD3/CD22的JNJ-8780也主要用于NHL,强生于2020年9月启动了该药物的首次临床试验(NCT04540796)。2022年9月,JNJ-8780的临床足迹扩张至中国,然而在2023年10月强生主动终止了这一研究(CTR20222211)。
事实上,之后强生仍开展了有关JNJ-8780的临床试验,不过主要作为联合的选项出现。2023年11月,强生启动了JNJ-1493联合JNJ-8780或CD3/CD20/CD79b三抗JNJ-8543的试验(NCT06139406)。双抗+双抗甚至三抗的组合,还是一个待验证的新方向,也期待强生的突破。
血液疾病领域,强生还布局了一款潜在FIC双抗JNJ-9968,用于治疗骨髓纤维化。该药物靶向CD3/CALR,而CALR(钙网蛋白)是一个极其新颖的未成药靶标,全球在研药物也仅有4款。有研究[1]证实,暴露在表面的CALR可以作为NK细胞的内源性激活剂,向骨髓细胞传递强大的促吞噬信号,协调先天免疫监视的各个方面。
在自免领域,强生也扎下了较深的根基,乌司奴单抗、英夫利昔单抗、古赛奇尤单抗、戈利木单抗等生物制剂每年为其带来了可观的业绩增量。从药物类型来看,这些产品都属于单抗,自免领域双抗药物的迭代也在推进中。
靶向IL-4Rα/IL-31的NM26治疗特应性皮炎(AD)的I期研究于2023年5月启动。一年后,强生又以8.5亿美元现金收购了聚焦于免疫学的Proteologix,目的就是丰富自免双抗管线。收购而来的IL-13/TSLP双抗PX128和IL-13/IL-22双抗PX130均处于临床前阶段,两者主要适应症都覆盖了AD。
针对AD,强生全球免疫疗法负责人David Lee认为双抗有“实现最佳疾病疗效的机会”[2]。AD是一种异质性疾病,不同的患者亚群有不同的致病通路,“目前的AD疗法要么仅能抑制单一致病通路且疗效有限,要么具有广泛的免疫抑制作用,但又会导致严重的安全性问题”,而双抗可以同时针对两种不同的致病通路,可能提供高标准疗效和缓解。
强生在双抗赛道的布局,策略性覆盖了实体瘤、血液学和自免领域这几个优势业务板块。目标明确,火力集中,如此步步为营之下,强生的收获是必然的。
阿斯利康:倾力打造肿瘤免疫双抗“双子星”
阿斯利康在双抗赛道上的布局渐近收获期。靶向PD-1/CTLA-4的volrustomig和靶向TIGIT/PD-1的rilvegostomig这两款肿瘤免疫(IO)双抗均已进入III期临床阶段,共同瞄准NSCLC大适应症,也是阿斯利康着重打造的“双子星”。
在肺癌领域,阿斯利康凭借一个个重磅产品持续引领着临床治疗变革,从一代EGFR-TKI吉非替尼到三代的奥希替尼,PD-L1单抗度伐利尤单抗和HER2ADC德曲妥珠单抗肺癌适应症的快速拓展,又不断稳固阿斯利康肺癌领导者的地位。阿斯利康与第一三共合力打造的TROP2ADC药物Dato-DXd也已申报上市,尝试覆盖非鳞状NSCLC人群。
有了小分子、单抗、ADC不同类型的产品之后,阿斯利康并没有停止对新技术的追逐,而且它希望立足现有产品基础打出一套更强的组合拳。双抗就是阿斯利康实现上述目标的重要资产。
透视现有的临床布局,可以发现阿斯利康为IO双抗开辟的版图主要围绕联合治疗展开。一方面是IO双抗与化疗的联合,可能实现比PD-1单抗更强的疗效。2023年10月,阿斯利康启动了volrustomig联合化疗一线治疗PD-L1表达<50%的NSCLC的III期研究(NCT05984277),头对头K药。今年10月,阿斯利康又登记了rilvegostomig联合化疗一线治疗PD-L1阳性的非鳞状NSCLC的III期头对头研究(NCT06627647),同样对标K药。
在挑战K药的道路上,已经有先行者取得胜利。在一线治疗PD-L1阳性NSCLC的III期HARMONi-2研究中,康方生物的PD-1/VEGF双抗依沃西单抗相较于K药实现了更显著的PFS获益。
另一方面,阿斯利康倾力挖掘更具竞争力的“IO+ADC”组合。比如,rilvegostomig与Dato-DXd的联用。围绕该组合,阿斯利康已先后启动TROPION-Lung10和TROPION-Lung12两项III期研究,分别针对一线治疗PD-L1高表达的非鳞状NSCLC和辅助治疗IB-IIIB期NSCLC场景。
此外,靶向PD-1/TIM-3的sabestomig和靶向EGFR/c-Met的FPI-2053也可能有治疗NSCLC的潜力。Sabestomig已读出单药二线治疗IIIB-IV期NSCLC的I/IIa期研究数据(NCT04931654),19例患者中有2例实现未确认的部分缓解(PR)。
值得一提的是,上述双抗不仅在阿斯利康的肺癌布局中扮演重要角色,也是其进击消化道肿瘤领域的潜在利器。II期GEMINI-Gastric研究显示,接受rilvegostomig联合化疗治疗的40例HER2阴性胃或胃食管交界腺癌患者的确认ORR为52.5%。
靶向CD3/CLDN18.2的AZD5863(HBM7022)主攻胃癌、食管癌和胰腺癌等,由阿斯利康于2022年4月从和铂医药引进来的,交易时其还处于临床前开发阶段。“通过临床前资料,我们发现HBM7022在包括胃癌和胰腺癌在内的实体瘤中表现出强大的潜在功效。”阿斯利康肿瘤研发负责人Susan Galbraith当时表示。敢于在早期就出手押注,也充分说明阿斯利康对于这款中国创新资产的看好。
在实体瘤领域之外,阿斯利康也有两款双抗已推进至III期临床阶段,即gefurulimab和AZD0486。开发gefurulimab的主要目的是为涉及末端补体途径激活的慢性疾病患者提供皮下治疗选择。这是一种迷你双抗(25kD),由一个N端白蛋白结合型VHH和一个C端C5结合型VHH通过柔性linker连接而成。如此设计的巧妙之处在于,较小的分子量可以带来更好的渗透性,与白蛋白的结合能够延长其半衰期。
CD3/CD19靶向的AZD0486由阿斯利康以超12亿美元收购TeneoTwo获得。通过单药或联合BTK抑制剂、CD20靶向疗法治疗,AZD0486有望解锁滤泡性淋巴瘤(FL)、弥漫性大B细胞淋巴瘤(DLBCL)等血液肿瘤适应症。今年8月,阿斯利康已经启动AZD0486联合CD20单抗利妥昔单抗一线治疗FL的III期试验(NCT06549595),计划招募1005例患者。
随着4款不同作用机制的双抗管线相继进入III期临床阶段,阿斯利康已经成为双抗赛道上实力不容小觑的明星玩家。结合联合治疗的策略打法,这些双抗可能将与更多已上市产品形成紧密捆绑的关系,为未来的市场竞争做好铺垫。
推荐阅读
吉林敖东“炒股”,荒了医药主业
近年来,上市公司“不务正业”投入巨资炒股致亏的情况屡屡发生,这也导致了云南白药在内的多家公司宣布停止“炒股”。
裁员互撕,2024年,医药人“倒霉让人心疼”
2022年,生物医药行业露了下行的苗头;2023年,裁员潮开始;2024年,下行不但没有结束,还有了愈演愈烈的意思。
国药集团大举并购!医药流通巨头掀起新一轮浪潮?
为应对行业变局和市场竞争,医药流通巨头们正在按下并购加速键,以期加快推进纵向一体化发展,进一步提高综合效益和核心竞争力。