三地创新药利好全解析:取消医院用药数量限制
继“创新药”首次被写入今年政府工作报告后,促进医药创新的支持政策正在全国各地密集推出。
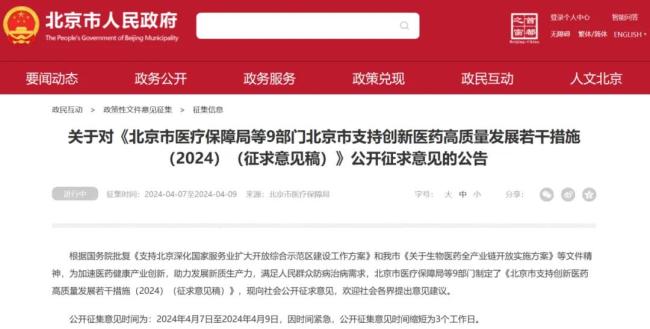
日前,北京市医疗保障局等9个部门联合制定的《北京市支持创新医药高质量发展若干措施(2024)(征求意见稿)》(下称《征求意见》)公开征求意见,提出将从临床研究端、审评端、进出口贸易端、支付端、数据端、投融资端等全链条支持创新医药行业发展。值得注意的是,本次公开征集时间为4月7日—9日,仅3个工作日,时间紧急程度足见北京推动生物医药创新的速度和力度。
无独有偶,广州、珠海两地也在近日发布了支持创新医药高质量发展的相关文件,分别是《广州开发区(黄埔区)促进生物医药产业高质量发展办法》(下称《办法》)以及《珠海市促进生物医药与健康产业高质量发展若干措施(征求意见稿)》(下称《措施》),将促进区域医药创新提上各自的工作日程。可以预见的是,新一轮的医药创新大戏将在全国范围内上演。
业内人士表示,细看三地文件,各地支持措施详尽具体,鼓励创新力度极大。但每个地方的政策侧重点有所不同,北京提出的举措主要集中在缩短创新周期和提高创新效率上,将加速临床研究与审评审批、拓展支付渠道等关键环节;而广州、珠海则体现在真金白银的支持上,加大资金投入与产业环境建设。利好政策之下,我国创新药行业将迎来发展加速期。
北京全链条支持创新药研发驶入快车道
北京的《征求意见》主要包括八个部分:
第一,着力提升创新医药临床研究质效;
第二,助力创新药械审评审批;
第三,大力促进医药贸易便利化;
第四,加力促进创新医药临床应用;
第五,努力拓展创新医药支付渠道;
第六,鼓励医疗健康数据赋能创新;
第七,强化创新医药企业投融资支持;
第八,保障措施。
临床研究端的支持体现在,北京将支持药物临床试验申办方在递交临床试验申请时同步向临床试验机构提交材料,实现立项审查、伦理审查、合同审查同步开展。同时加强对医疗机构的评价和激励,将临床试验启动整体用时压缩至28周以内,并持续加速。支持重点企业实现全球同步开展临床试验。
此外,北京也将对创新医药企业实施重点项目制管理机制,在注册申报、许可办理等方面“一品一策”、提前介入、全程指导,到2024年底累计纳入项目制管理品种数量提升至200项。
为将罕见病药物尽快推上临床普及患者,《征求意见》还在第三部分指出,将在北京天竺综合保税区建立罕见病药品保障先行区,实施罕见病药品“白名单”制度(罕见病药品、试点医疗机构、进口药品经营企业三个“白名单”),打通一次审批、多次进口、多家医疗机构使用的绿色通道,2024年力争推动10个品种全环节打通落地。
同时,第七部分指出,将用好北京市医药健康产业投资基金,带动社会投资,推动一批具有战略性、前沿性的全球原创技术和品种在京转化,支持一批有重大潜在产值贡献的创新药械、细胞与基因治疗、数字医疗等领域产业项目落地并实现产品快速上市。
业内人士表示,随着此次文件的出台,北京对支持创新药械的方向更加明确,各部分内容协调配合,将覆盖创新药开发应用全链条。这对面对巨大的临床需求,需要争分夺秒创新的药企而言,可谓巨大政策利好。随着后续政策细节的进一步落地,医药产业将会在高质量发展的道路上走得越来越坚实。
广东加大资金支持全方位赋能医药创新
而广东多地政策集中发布,更多体现的是地方政府真金白银大力扶持医药高质量发展的决心。
根据广州发布的《办法》,其将对具有全球影响力的大师、战略科学家领衔的具备颠覆性技术创新突破、应用前景明确广阔的若干生物医药顶尖项目,在项目科技研发、成果转化和产业化阶段,将按照《广州促进生物医药产业高质量发展若干政策措施》相关规定,按“一事一议”原则由市、区共同给予人才奖励、研发和产业化奖励、投资入股、贴息贷款等全链条支持,最高支持额度50亿元,支持期限最长5年。
具体来看,对创新药、改良型新药和生物类似药,在国内临床试验研发费用投入1000万元以上的,广州也将根据其临床研发进度,分阶段最高按实际投入临床研发费用的40%给予资助:完成Ⅰ、Ⅱ、Ⅲ期临床试验的,经认定,分别给予最高1000万元、2000万元、3000万元扶持,单个企业每年最高资助1亿元。
对首次取得FDA新药临床试验许可并在本区进行转化的新药,广州将给予30万元资助,单个企业每年最高资助200万元。对新取得FDA批准,获得境外上市资质并在相关国外市场实现销售的药品,广州将对每个品种给予最高100万元一次性资助。
该文件一大亮点还在于,广州强调将着重加快技术平台建设、推动CRO集聚发展。例如,广州将对该区域CRO按收入梯度进行租金补贴。对当年营业收入1亿元以上且同比实现正增长的CRO,按照实际租金的80%给予补贴。单个企业每年最高补贴100万元,最多补贴3年。对年度营业收入1亿元以上、2亿元以上、3亿元以上、5亿元以上、10亿元以上,且同比实现正增长的CRO,分别给予100万元、200万元、300万元、500万元、1000万元资助。
与广州思路一致,珠海同样采取一系列资金支持举措,并重点关注建设产业发展环境,培育壮大生物医药与健康产业集群。
《措施》指出,珠海将对化学药品1-2类、生物制品(按药品管理的诊断试剂除外)、中药(中药创新药、中药改良型新药),根据研发各阶段成果给予奖励。对完成I、II、III期临床试验阶段(完成关键性临床试验可根据实际情况判定视为完成I、II或III期临床),珠海分别给予最高300万元、500万元和1000万元一次性奖励。
对获得药品注册证书并实现销售的,珠海按药品注册分类标准给予最高1000万元奖励。对创新型高端制剂(包括纳米粒、微球、脂质体、控释、缓释剂型以及微针等创新剂型)单品种首个注册证书再给予100万元奖励。对创新药研发期间获得突破性疗法和附条件批准的,再给予100万元奖励。单个企业每年新药研发相关奖励最高不超过2000万元。
除药品外,珠海也在医疗器械创新方面作了部署。对新取得医疗器械首次注册证书并实现销售的第二类、第三类医疗器械产品,对通过国家、省级创新医疗器械特别审批程序首次获得二、三类医疗器械注册证书的产品,珠海亦给予奖励,最高可获得300万元,单个企业每年医疗器械相关资助最高不超过1000万元。
另外,对在全国同类仿制药中前三家通过一致性评价并实现销售的企业,产品纳入国家药械产品集中带量采购的企业,新取得FDA、EMA、PMDA、CE国外等机构注册认证的药品和医疗器械,对引进国外上市药品、医疗器械在珠海生产等等,皆可获得一定奖励。
值得一提的是,珠海还大力支持公共服务平台建设。将对获得生物医药与健康领域省级制造业创新中心认定的,奖励500万元,升级为国家级制造业创新中心的,再奖励500万元。并鼓励已获资格认定的生物医药与健康领域新型研发机构对外提供研发类公共技术服务。
在完善产业发展环境方面,《措施》明确对获评为广东省生物医药领域培育园区、示范园区、特色产业园的园区运营机构,给予100万元一次性奖励。
随批随进、补贴医院打通创新药落地“最后一公里”
值得注意的是,创新药进院作为研发链条上的“最后一公里”,一直是行业关注的重点。在北京、广州颁布的最新政策文件中,亦明确了加快创新药临床使用的具体要求和措施。
首先,北京市医保局在《征求意见》中明确取消医疗机构药品数量限制,要求国谈药目录公布后一个月内召开药事会,全年药事会召开不少于4次,加快国谈药货款支付,并将国谈药使用情况纳入本市公立医疗机构绩效考核和定点医疗机构总额预算(BJ-GBI)管理。《中关村创新医疗器械产品目录》按季度更新,推进目录产品进入医院,实施创新药械“随批随进”。
在医保政策方面,北京也将继续深化配套政策,除了推进二级及以上医院和药店实施双通道外,还将门特使用的国谈药品纳入门诊特病管理,提高报销比例,并将治疗费用较高的国谈药品纳入按固定比例支付。
在新药新技术费用方面,北京将不断完善CHS-DRG付费新药新技术除外支付机制,及时完成形式审查、数据验证及专家论证,对符合条件的新药新技术费用,不计入DRG病组支付标准,单独支付;同时,国谈药和创新医疗器械涉及的诊疗项目,不受医疗机构总额预算指标限制;对医疗机构开展绩效考核和总额预算管理(BJ-GBI)质量评价时,剔除国谈药、创新诊疗项目对人均药品费用、人均医疗费用等相关指标的影响。
针对创新药进院难的问题,广州则采取了补贴医院的做法。《办法》明确对辖区内二级以上医疗机构,用药目录每新增1个创新药品/医疗器械目录中创新药的,给予医疗机构20万元资助;同时,按采购创新药品/医疗器械目录品种金额20%给予资助。每家医院每年最高资助300万元。
同时,对进入国家医保谈判药品的创新药品/医疗器械目录品种,广州也鼓励各医保定点医疗机构在新版国家医保药品目录正式公布后一个月内召开药事会,按需纳入药品采购目录范围。
事实上,全国各地为破解创新药进院难题已经进行了一系列探索。2024年1月,四川省卫健委办公室发出《关于进一步做好医疗机构药品器械管理有关工作的通知》,取消医疗机构用药数量,要求3个月内开药事会,打通国谈药物落地最后一公里。
在此之前,2023年7月,上海也发布了《上海市进一步完善多元支付机制支持创新药械发展的若干措施》,从支付端让医疗机构“敢进”创新药械是其中重要内容。在业内看来,这项举措不仅利好国谈药物进院及使用,同时也利好其他药品的进院准入,创新堵点正在被加速打通。
业界普遍认为,2023年8月国务院常务会议审议通过的《医药工业高质量发展行动计划(2023-2025年)》,为医药行业接下来的发展指明了前进方向和路径。进入2024年,医药创新的支持政策明显加速落地,北上广等地已经吹响创新号角,预计未来会有更多区域持续跟进。随着未来政策落地路径的进一步明确,创新药行业发展将迎来提速换挡。
推荐阅读
2023中国创新药上市公司TOP15,揭示产业格局?
2023年对于国内上市创新药企来说,是面临巨大挑战和困境的一年,这些挑战来自外部环境也来自内部变革。
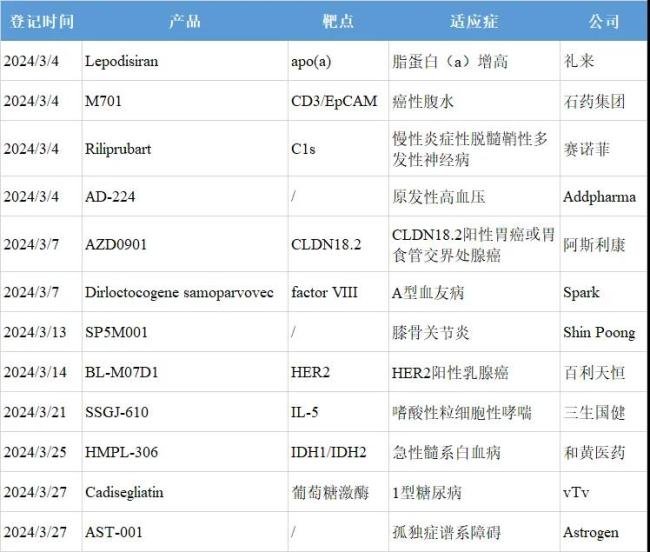
12款创新药进入III期,5款来自中国药企
根据全球临床试验收录网站clinicaltrials和中国临床试验登记平台chinadrugtrials,3月共12款创新药进入III期阶段,其中5款来自中国药企。
多地发布创新药鼓励政策:北京更全面,广州更实惠
4月7日晚,一份公告让行业炸了锅:北京市医疗保障局等9部门发布《北京市支持创新医药高质量发展若干措施》,向社会公开征求意见,9日截止。
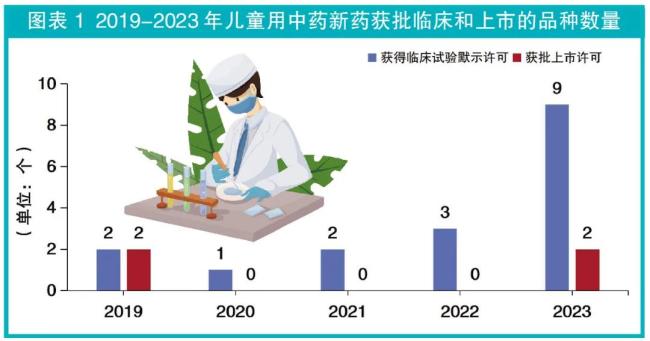
盘点:我国儿童用中药新药审批进展
中药在儿科领域临床中应用广泛,但儿童群体可用的中成药相对较少。2019年颁布的《中华人民共和国药品管理法》明确,国家鼓励运用现代科学技术和传统中药研究方法进行中药开发,同时鼓励儿童用药品的研制和创新。
Ionis公布反义寡核苷酸新药III期研究完整数据
4月7日,Ionis Pharmaceuticals公布了Olezarsen治疗家族性高乳糜微粒血症综合征(FCS)的III期Balance研究全部结果。
贝达药业:4亿美元引进的1类新药在中国获批临床
中国国家药监局药品审评中心官网公示,贝达药业从C4 Therapeutics(C4T)引进的1类新药CFT8919片已获得临床试验默示许可,拟开发用于治疗携带EGFR突变的局晚期或晚期非小细胞肺癌(NSCLC)患者。
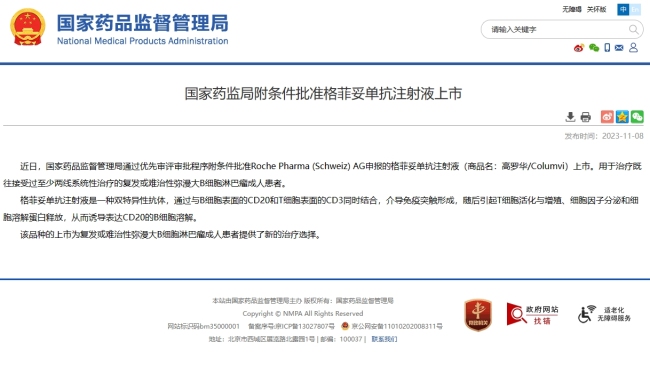
弥漫大B细胞淋巴瘤迎新药,中国上市搅动221亿市场
国家药监局通过罗氏申报的格菲妥单抗注射液上市,为复发或难治性弥漫大B细胞淋巴瘤成人患者提供新的治疗选择。
财务造假,欺诈发行,思创医惠爆雷恐误伤社保基金
近期行情低迷,造假被罚的公司就更让人解气。继东方时尚、我乐家居之后,思创医惠也因财务造假、欺诈发行,被罚近亿元。
波司登营收增速创近7年新低 押注高端化掣肘仍存
波司登逐渐走上了“奢侈”羽绒服赛道,让消费者直呼“穿不起”。过去几年波司登一直在探索多产品的四季化战略,由于经验及竞争优势不足,效果不佳。