红斑狼疮生物制剂热浪席卷!GSK携手恩沐生物,大交易背后能否巩固优势?
自身免疫疾病领域的新药研发已经成为国内外企业关注的重点,其中以系统性红斑狼疮(SLE)为代表的潜力市场不容小觑。
日前,葛兰素史克(GSK)官方发布消息,其与中国创新药企业恩沐生物(Chimagen Biosciences)达成关于三特异性抗体CMG1A46的收购协议。据此,GSK将向恩沐生物支付3亿美元的预付款,从而获得CMG1A46的全部全球权利(除大中华区外)。此外,恩沐生物还将有资格获得总额为5.5亿美元的CMG1A46基于成功的开发和商业里程碑付款。
 值得关注的是,GSK计划开发和商业化CMG1A46,重点聚焦系统性红斑狼疮(SLE)、狼疮性肾炎(LN),以及有可能扩展到其他B细胞驱动的自身免疫性疾病。作为SLE治疗领域的老玩家,此前GSK的贝利尤单抗(Belimumab)取得的研发成果和商业化成功,也让行业对CMG1A46未来的市场潜力充满期待。
值得关注的是,GSK计划开发和商业化CMG1A46,重点聚焦系统性红斑狼疮(SLE)、狼疮性肾炎(LN),以及有可能扩展到其他B细胞驱动的自身免疫性疾病。作为SLE治疗领域的老玩家,此前GSK的贝利尤单抗(Belimumab)取得的研发成果和商业化成功,也让行业对CMG1A46未来的市场潜力充满期待。
业内观点认为,GSK此次重金收购恩沐生物CMG1A46商业化权益的行为,对于自免市场的看重和系统性红斑狼疮治疗领域潜力的把握,体现出GSK在细分领域希望进一步扩大市场优势的决心。同时,国际市场众多生物制药企业对自身免疫疾病领域虎视眈眈,众多生物制剂潜力品种的布局,也预示着自免领域的竞争格局将日趋激烈。
GSK收购新药引发关注,SLE治疗或遇新希望?
系统性红斑狼疮(Systemic lupus erythematosus,简称SLE)是一种主要由免疫系统异常激活,而攻击自身组织导致的慢性弥漫性结缔组织病。此病的具体病因尚不明确,但可能与遗传、环境因素与雌激素有关。长期的阳光暴晒、特定药物使用、感染,以及口服雌激素均可能诱发系统性红斑狼疮症状加重。此病易发于育龄女性,尤其是10到40岁的人群,女性发病率明显高于男性,约9:1。
目前对于轻型系统性红斑狼疮的患者,无明显的内脏损害,会采用非甾体类药物控制关节炎,用抗疟药如羟氯喹、沙利度胺等药物治疗轻症SLE;对于中型活动性系统性红斑狼疮的患者,可个体化的使用免疫抑制剂、糖皮质激素治疗,如甲氨蝶呤、泼尼松等;对于重型的系统性红斑狼疮的患者,可用大剂量的糖皮质激素、免疫球蛋白冲击治疗,待病情缓解后接受维持治疗。但传统疗法的控制效果,以及可能发生的副作用,均让临床治疗存在着未被满足的需求,这也给生物制剂的创新与应用带来的空间。
CMG1A46是恩沐生物基于其TRIAD平台开发的一款大小为151KD的IgG样“1:(1+1)”三特异性抗体。它能够同时靶向T细胞上的CD3受体以及肿瘤细胞上的两个不同的生物标记物CD20和CD19,通过募集T细胞杀死表达CD19和/或CD20的肿瘤细胞,用于治疗多种耐药和复发的B细胞血液肿瘤,是目前全球首个进入临床的抗CD3/CD19/CD20三抗产品。
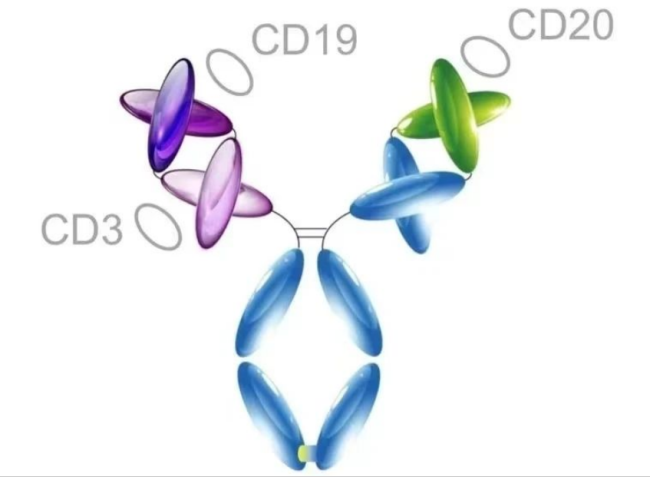
2022年10月,恩沐生物官方宣布,其全球首款针对恶性B细胞血液肿瘤的T细胞介导三抗CMG1A46的I期临床试验,已在美国完成首例受试者给药。这项研究旨在评估CMG1A46在人体的安全性和初步有效性。
2020年12月,恩沐生物在美国血液学会(ASH)年会上以口头报告的形式公布其抗CD3/CD19/CD20三特异性抗体CMG1A46针对非霍奇金淋巴瘤的临床前研究结果。实验数据显示,CMG1A46展现出以剂量依赖性方式通过人PBMC(外周血单个核细胞)介导肿瘤细胞裂解。与具有常规“1:1”基于IgG的形式的CD3×CD20双特异性抗体相比,CMG1A46具有更强的效力和安全性。

体内研究显示,在植入人PBMC的小鼠模型中,CMG1A46显示出了较强的肿瘤抑制活性,并诱导了CD19+/CD20+淋巴瘤和CD19+/CD20-肿瘤快速消退。本次试验采用的CMG1A46剂量是传统CD3×CD20双特异性抗体的6倍(CMG1A46为3mg/kg,常规为0.5mg/kg),并且具有更高的抗肿瘤效力,而毒性却没有任何明显的增加。据悉,GSK计划于2025年开始在狼疮患者中进行I期试验。如果在这一阶段能够展现出良好的安全性和初步的有效性,那么将为后续的临床试验奠定坚实的基础。
值得关注的是,早在GSK收购恩沐生物的CMG1A46前,这款产品的商业化价值已经得到了关注。2021年11月9日,恩沐生物曾向博锐生物授权其另一款三特异抗体CMG6A19的临床前开发和在大中华地区的临床注册、开发、生产以及商业化。恩沐生物将由此获得来自博锐生物的累计超过1亿人民币的含首付款和研发及销售里程碑付款,以及基于大中华区内CMG6A19的销售分成。
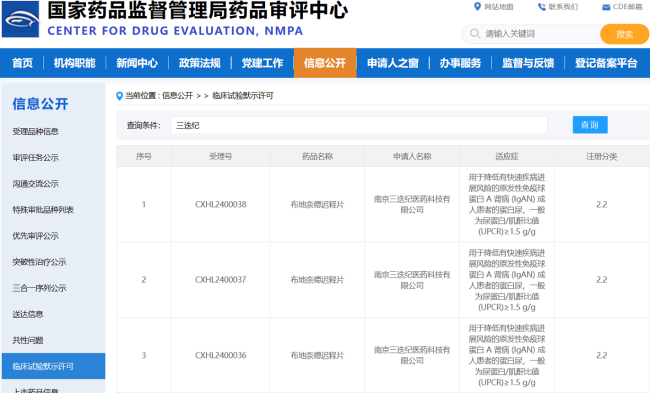
今年1月18日,国家药监局药品评审中心(CDE)官网披露,博锐生物与恩沐生物(Chimagen)共同申报的1类新药BR115注射液获批临床,拟开发治疗晚期恶性实体瘤,该BR115便是当时双方合作的CMG6A19。
在SLE治疗领域GSK可以说是早有布局,并通过从外部引入项目丰富管线。然而,近年来GSK在自身免疫疾病领域并购引进诸多项目遇到了失败,结果不尽如人意。2022年10月,GSK曾宣布其GM-CSF单抗otilimab用于中度至重度类风湿性关节炎(RA)的III期ContRAst-3研究失败,未达到主要终点,并决定不再递交上市申请。这一结果无疑对GSK在自身免疫性疾病领域的研发管线造成了一定的影响。
贝利尤单抗在自免药物市场的崛起,显然让GSK看到了细分领域的曙光。作为一款靶向BLyS的人源化单克隆抗体,贝利尤单抗最早于2011年3月获得FDA批准上市,2019年7月获批进入国内市场。从2018年全球销售额超过6亿美元,逐步增长为全球销售额超过10亿美元的“重磅炸弹”,销售额年增长超过20%,为GSK带来丰厚利润。
生物制剂研发如火如荼激烈角逐谁与争锋?
从全球医药研发的大背景来看,自身免疫性疾病一直是科研攻关的重点和难点领域。这类疾病的发病机制复杂多样,涉及免疫系统的多个环节失调,研发出针对性强、疗效显著且安全性高的治疗药物需求迫切,大分子生物制剂在提高缓解率,降低疾病活动度,复发率和减少激素用量等方面正在发挥越来越重要的作用。放眼全球,不只GSK,诺华、赛诺菲等也是自身免疫疾病领域企业中的佼佼者。
诺华在SLE领域有十分深入的布局,如伊利尤单抗(Ianalumab VAY736),其在治疗干燥综合征和SLE的Ⅱ期临床试验中均获得积极结果,目前正在Ⅲ期临床试验中接受检验。此外,诺华的CAR-T疗法YTB323也显示出治疗严重难治性自身免疫性疾病的潜力,包括SLE。该疗法Ⅰ/Ⅱ期临床试验中表现出持久降低SLE疾病活动指标的效果,目前诺华正在准备开展Ⅱb/Ⅲ期临床试验,以开展严重难治性SLE和狼疮肾炎患者治疗研究。
赛诺菲在SLE领域也拥有多款在研药物,其中,一些药物已经取得了显著的临床进展,如度普利尤单抗(Dupixent),虽然度普利尤单抗最初并非专为SLE设计,但其在治疗特应性皮炎和哮喘等Ⅱ型炎症相关疾病方面的成功,为赛诺菲在SLE领域的研发提供了宝贵的经验和信心。同时,赛诺菲还有其他针对SLE潜在疗法的研发布局,在研药物可能通过抑制特定的炎症通路或细胞信号传导来减轻SLE的炎症和症状。
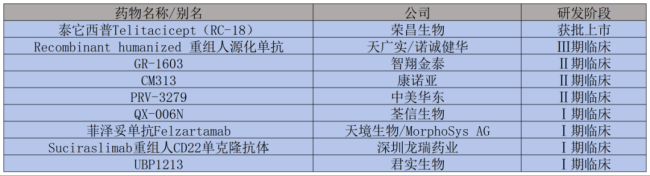
国内制药企业在SLE的生物制剂研发竞争同样十分活跃,像恒瑞医药、荣昌生物、康诺亚、智翔金泰等在大分子药物也有深入的布局,创新浪潮如火如荼。
泰它西普(RC18,商品名:泰爱®)是由荣昌生物自主研发的全球首款、同类首创的注射用重组B淋巴细胞刺激因子(BLyS)/增殖诱导配体(APRIL)双靶点新型融合蛋白产品。目前,泰它西普于2021年3月国内获批系统性红斑狼疮(SLE)适应症,并于同年底进入国家医保药品目录。泰它西普的另外两个适应症分别为类风湿关节炎和全身型重症肌无力;其中类风湿关节炎适应症于2024年7月获批上市,用于治疗全身型重症肌无力的上市申请于今年10月获得CDE受理,并被纳入优先审评审批程序。
恒瑞医药自主研发的抗体-细胞因子融合蛋白SHR-2001,临床皮下注射给药,拟用于治疗自身免疫性疾病。2023年2月28日,SHR-2001的IND申请被NMPA受理。2023年5月21日,恒瑞医药发布公告称,其子公司广东恒瑞医药有限公司已收到NMPA核准签发的关于注射用SHR-2001的《药物临床试验批准通知书》,同意该药品进行系统性红斑狼疮适应症临床试验。
业内分析指出,尽管SLE的治疗仍然面临诸多挑战,但研究者们仍在不断努力,探索更安全、有效的治疗方法,以期为患者带来更好的预后和生活质量。与此同时,SLE治疗领域的研究近年来取得了显著进展也是不容忽视的,随着现代科学研究技术的发展,研究者们对SLE的发病机制也有了更深入的认识。国内外的医药企业也在SLE治疗领域有更加广阔和深入的布局,未来会有更多的SLE治疗药物登陆市场,竞争格局趋于激烈。
推荐阅读
百济“神秘”大股东,狂“买”中国创新药!这家对冲基金有何来头?
Seagen曾经最大股东,百济神州第二大股东,康方合作伙伴Summit第四大股东,如今所投资的海思科海外合作方再登IPO舞台。
“Newco模式”火了!嘉和、康诺亚、恒瑞之后,资本攒局创新药出海前景几何?
通过与海外资本合作成立新公司的“NewCo模式”出海,正成为本土创新药企实现国际化战略的一种新趋势。
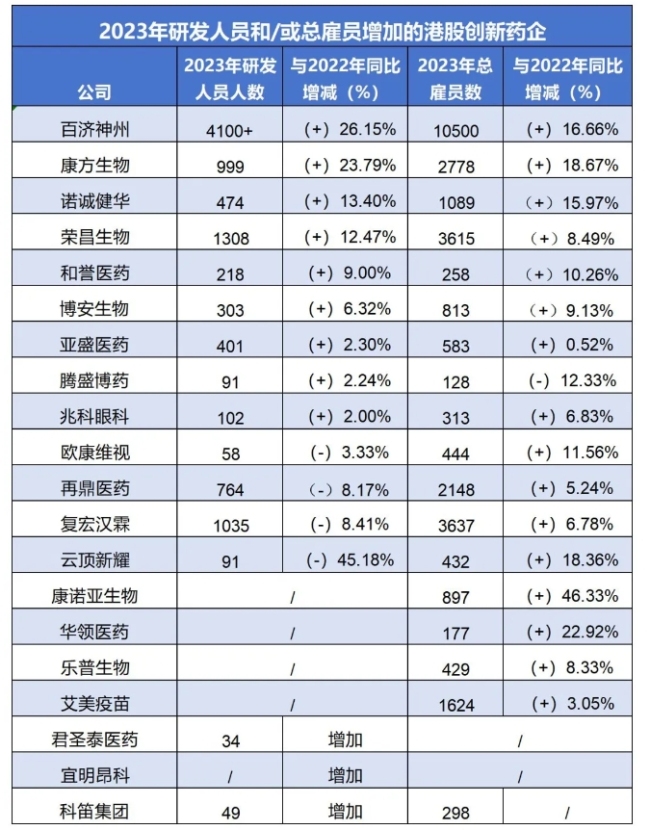
百济神州总雇员过万,康方生物员工数大增18.7%,港股创新药企还有谁在“屯兵”?
“降本增效”似乎成为众多企业面向2024的一致方向,但在趋冷的大环境下,仍有创新药企在逆势“屯兵”。