体重多减47%!礼来公布「单挑」司美格鲁肽数据
替尔泊肽“单挑”司美体重多减了47%
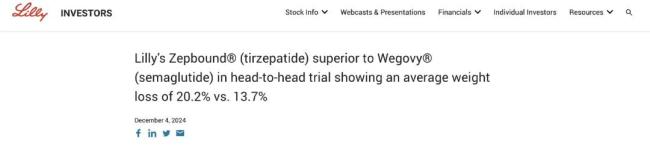
当地时间12月4日,礼来公布了SURMOUNT-5的3b期临床研究结果,其减重版替尔泊肽(Zepbound)组的受试者在第72周时减掉了50.3磅(22.8公斤)的体重,同期减重版司美格鲁肽(Wegovy)组受试者减掉了33.1磅(15公斤)。
与司美格鲁肽相比,替尔泊肽的平均减重效果高出47%。
SURMOUNT-5是一项多中心、随机、开放标签的头对头研究,旨在评估替尔泊肽与司美格鲁肽在肥胖或超重成年人中的疗效和安全性,这些成年人至少伴有一种如高血压、血脂异常、阻塞性睡眠呼吸暂停或心血管疾病的共病,且未患有糖尿病。
试验共招募了751名参与者,按1:1的比例分配接受最大耐受剂量的替尔泊肽(10mg或15mg)或司美格鲁肽(1.7mg或2.4mg)。
72周时,替尔泊肽组受试者的体重平均降幅为20.2%,而司美格鲁肽组的平均降幅为13.7%。
结果还显示,72周时,替尔泊肽在主要终点和所有五个关键次要终点上都较司美格鲁肽表现出优效性。例如,替尔泊肽组体重减轻四分之一以上的患者占比达到31.6%,司美格鲁肽组占比16.1%。
礼来称替尔泊肽在SURMOUNT-5试验中的总体安全性表现与此前的SURMOUNT试验相似,暂未披露副作用方面的更多细节。SURMOUNT-5中,替尔泊肽和司美格鲁肽最常报道的不良事件与胃肠道相关,一般为轻至中度。
礼来表示将继续评估SURMOUNT-5的结果并发表在同行评审期刊上,预计也会在明年的医学会议上公布。
下一代“药王”?多家国内企业围猎司美
7月,减重版替尔泊肽注射液(商品名:穆峰达)在中国获批,是首个且目前唯一获批的GIP/GLP-1双靶点激动剂药物。
比替尔泊肽稍早获批的减重版司美格鲁肽(商品名:诺和盈),在获批5个月后,于今年11月正式在中国上市。
诺和诺德表示将根据肥胖症患者在全国的分布进行涵盖公立医院、私立医院以及药店等全渠道的布局。今年的进博会上,诺和诺德展台相关人员对赛柏蓝表示,下游医药商业等渠道已经表现出了极强的合作意向。
另外,诺和诺德已开始申请诺和盈的省级招标挂网,具体定价可参考挂网价格。
据了解,在零售药店,诺和盈注射液0.68mg/ml、2.27mg/ml和3.2mg/ml三种规格的标价分别为1264.9元、1893.7元和2463元。
司美格鲁肽、替尔泊肽针对中国患者的减重研究情况

从全球销售数据看,今年前三季度,减重版替尔泊肽(Zepound)收入30.18亿美元,降糖版(Mounjaro)收入80.1亿美元,两者合计贡献了110.28亿美元营收,占礼来前三季度总收入的34%左右。
得益于上市更早等因素,司美格鲁肽目前在全球市场占据的市场较替尔泊肽更庞大。
今年前三季度,减肥版司美格鲁肽注射液(Wegovy)收入383.4亿丹麦克朗,约合55.32亿美元,同比增长77%;加上降糖版注射液(Ozempic)和口服片(Rybelsus),司美格鲁肽前三季销售额约203.46亿美元。
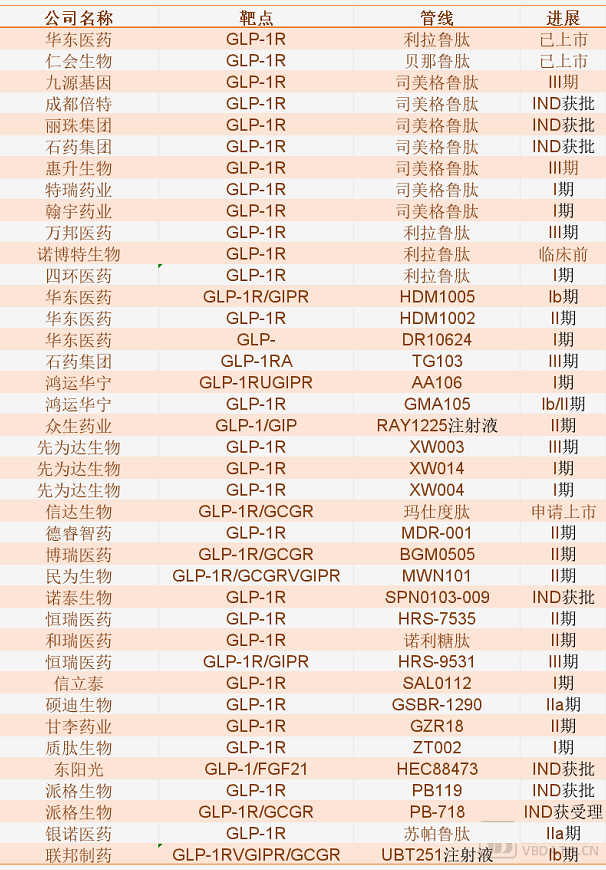
随着GLP-1大热,司美格鲁肽普遍被认为有望成为新一代全球“药王”。在此背景下,不止礼来选择“单挑”司美格鲁肽,众多国内药企也展开了布局。
在减重方面,翰宇药业启动了三期临床研究,在肥胖患者中比较HY310注射液与诺和盈治疗44周的疗效和安全性;信达生物GLP-1/GCGR双重激动剂玛仕度肽展开的临床中也包括与司美格鲁肽的头对头研究,该药的减重适应证有望明年获批。
在糖尿病领域,博瑞医药今年8月宣布,其BGM0504注射液在二型糖尿病二期与司美格鲁肽注射液头对头研究中取得积极结果。博瑞医药在投资者调研报告曾表示,其临床研究纳入人群的糖化血红蛋白(HbA1c)和体重这类基线水平与司美格鲁肽、替尔泊肽及其他同类品种在中国所开展的一系列研究具有较好可比性,保持在基本一致的水平。
有数据显示,全球受肥胖困扰的人群已达到10亿,全球每年至少有280万超重或肥胖成年人死亡,然而目前政府和大众对肥胖的关注度仍然不及其它慢性疾病,从这一角度出发,减重药物的潜力自不待言。
短期内,GLP-1领域仍是诺和诺德与礼来的天下,随着更多药物获批、更多企业入局,市场份额争夺将更加激烈,减重疗效、用药便捷性、不良反应程度以及价格等都将成为各家企业的竞争点所在。
推荐阅读
“减肥神药”国内获批,号称体重能降17%!有人称用后腹泻、头晕…或致阳痿?
该文章指出,接受司美格鲁肽处方的非糖尿病男性更容易出现勃起功能障碍(阳痿,ED)。
涉老保健品虚假宣传何时休?央视再曝普通食品伪装“神药”
我国营养健康市场就像一座空中楼阁,缺乏科学技术、政策法规和营商环境的有力支撑,须各界有识之士潜心研究、聚力解决!
重磅!最火的减肥针来了!司美格鲁肽减重适应症国内获批,国内还有哪些核心玩家?
首个用于长期体重管理的GLP-1RA周制剂诺和盈®在中国获批了,这也意味着减重市场最大的参与者诺和诺德开始了新一轮“攻城略池”行动。
司美格鲁肽国内药企竞速!丽珠BLA上市获受理,九源基因/华东医药能否率先冲线?
在健康需求增强和市场激增的影响下,司美格鲁肽在全球持续大卖,国内市场的参与者也开始全力冲刺。
艾伯维急了!起诉百济神州
9月12日,国内舆论开始关注到艾伯维起诉百济神州一事,艾伯维称百济的BTK嵌合式降解激活化合物(CDAC)BGB-16673侵犯了自己的商业秘密。