千亿自免赛道爆发!IL-23R口服靶向药加持,强生能否如愿称王?
在临床需求的驱动下,自身免疫性疾病领域已逐步成为全球药企所高度重视并重点投入的细分市场。
日前,强生宣布了一项重要进展,其开发的口服白细胞介素-23受体(IL-23R)拮抗剂Icotrokinra(JNJ-2113)在治疗12岁及以上中重度斑块状银屑病(PsO)患者的III期ICONIC-LEAD研究中取得了积极的关键性结果。这意味着Icotrokinra作为首款选择性阻断IL-23R的靶向口服肽类药物,在治疗银屑病方面迈出了坚实的一步,或将为患者提供了更为便捷、有效的治疗选择。

值得注意的是,银屑病发病机制复杂,适合设计成小分子的靶标相对较少,而针对各类细胞因子开发的药物则占据了较大比例。因此,过去该领域的药物开发策略主要集中于注射抗体为主的生物制剂。然而,Icotrokinra的成功研发为这一传统格局带来了突破,展示了口服小分子药物在治疗银屑病方面的巨大潜力。
随着自身免疫疾病治疗领域的迅猛发展,IL-23R作为关键靶点,已吸引了众多国内外药企的广泛关注与布局。除强生外,艾伯维、礼来等制药巨头也纷纷涉足IL-23R赛道,竞相争夺这一领域的市场先机。业内人士指出,这一趋势不仅将推动IL-23R靶向药的研发进程,更有望为患者带来更多元化、更精准的治疗方案。
Ⅲ期临床研究告捷,口服IL-23R靶向药来袭
作为一种慢性免疫性疾病,斑块状银屑病给患者带来诸多痛苦,其症状包括红斑、鳞屑以及皮肤发炎引发的身体疼痛。据统计,全球有超过1.25亿例斑块状银屑病患者,其中约25%的病情达到中度至重度,亟需更有效的治疗手段。
强生携手Protagonist Therapeutics合作开发的Icotrokinra,作为全球首款靶向IL-23的口服拮抗多肽,正引领着银屑病领域新的治疗潮流。此次公布的ICONIC-LEAD研究是一项全球性、多中心、随机、双盲、安慰剂对照的临床试验,共纳入了684名患者,其中包括66名青少年。
该研究旨在评估Icotrokinra对比安慰剂治疗中度至重度斑块状银屑病的12岁及以上青少年和成人患者的安全性和有效性。研究设定了双重主要终点,即第16周达到银屑病面积及严重指数(PASI)至少改善90%(PASI 90)的患者比例,以及研究者总体评估(IGA,五分制)评分为0分或1分(IGA 0/1)且至少改善2分的患者比例。

结果令人振奋,Icotrokinra组在双重主要终点上均表现出色。治疗第16周时,与安慰剂组相比,Icotrokinra组患者达到PASI 90的比例显著更高(49.6% vs. 4.4%),实现IGA 0/1的比例也同样领先(64.7% vs. 8.3%)。此外,患者的应答率在第24周继续提升,Icotrokinra组分别有64.9%和74.1%的患者达到PASI 90和IGA 0/1。
在安全性方面,Icotrokinra的表现同样稳健。研究中,Icotrokinra组与安慰剂组发生不良事件(AE)的患者比例相似,分别有49.3%和49.1%的患者在第16周出现治疗期间不良事件(TEAE)。此外,针对特殊部位(如头皮、生殖器和/或手掌和脚掌)斑块状银屑病的III期ICONIC-TOTAL研究也取得了积极成果,进一步验证了Icotrokinra的广泛适用性。
Icotrokinra的成功并非偶然,其依托于Protagonist Therapeutics独有的多肽技术平台,成功打破了口服多肽生物利用度低、渗透性和稳定性问题以及胃肠道降解等开发难题。据悉,这款选择性阻断IL-23R的口服多肽药物,与IL-23R的结合亲和力可达到个位数的pM级别,展现出治疗IL-23R介导的斑块状银屑病及其他炎症疾病的巨大潜力。
与目前市场上已上市的IL-23产品均为单抗注射液不同,Icotrokinra的口服给药方式无疑为患者提供了更为便捷的治疗选择。此次III期研究达到主要终点后,Protagonist将获得1.65亿美元的里程碑付款,将助其进一步验证Icotrokinra这款重磅产品的临床潜力。
近年来,强生在银屑病领域的深耕细作有目共睹。从英夫利西单抗、戈利木单抗、乌司奴单抗到古塞奇尤单抗,强生不断推出创新药物,引领银屑病治疗的迭代升级。而今,随着口服IL-23R拮抗剂Icotrokinra的加入,强生在银屑病领域的影响力将有望进一步扩大。
回顾合作历程,强生与Protagonist Therapeutics自2017年达成许可和合作协议以来,双方合作不断深化。2019年,合作范围扩大至二代IL-23R药物;2021年,强生再次修订合作协议,获得包括Icotrokinra在内的两款二代IL-23R药物的全球权益。这一系列合作不仅彰显了强生对银屑病治疗领域的坚定信心,也预示着Icotrokinra未来在市场上的广阔前景。随着Icotrokinra在III期研究中取得积极结果,其正逐步迈向市场,或将成为强生征战自免赛道的重要落子。
押注口服银屑病疗法,自免领域竞争再升级
随着全球自身免疫性疾病患者数量的持续攀升,患者需求日益迫切,各大药企正加速布局,以期在这片蓝海市场中抢占先机。
据弗若斯特沙利文统计,全球自免患病人群总数已突破5亿大关,我国主要自免疾病患者也近4000万人。预计到2030年,全球自身免疫性疾病药物市场规模将飙升至1760亿美元,2022年至2030年的复合年增长率达3.6%。而中国市场规模更将实现惊人飞跃,预计2030年将达到近250亿美元,较2020年增长10倍,成为全球自免药物市场的重要增长极。
在这一市场中,众多重磅产品应运而生。强生的乌司奴单抗和艾伯维的利生奇珠单抗,均以银屑病为首发适应症,取得了显著商业化成功。其中,乌司奴单抗2023年销售额已突破100亿美元大关,利生奇珠单抗也将紧随其后迈过这一门槛。此外,诺华的司库奇尤单抗、强生的古塞奇尤单抗和礼来的依奇珠单抗等,均已成为数十亿美元级别的畅销品种。
针对斑块状银屑病的治疗,全球已获批22款靶向疗法,但口服疗法仍然稀缺。目前仅安进的PDE4抑制剂阿普米司特和BMS的TYK2变构抑制剂氘可来昔替尼为口服选择。在POETYK PSO-1/2两项头对头研究中,氘可来昔替尼展现出优于阿普米司特的治疗效果,被业界寄予厚望。
然而,就商业化表现而言,氘可来昔替尼似乎尚未达到市场预期。据悉,氘可来昔替尼已经来到上市的第三个年头,但今年前三季度销售额仅为1.63亿美元,全年预计销售额在2亿-2.5亿美元之间,与司库奇尤单抗、古塞奇尤单抗等上市初期即快速放量的畅销药物相比,尚有一定差距。
此时,强生开发的Icotrokinra取得临床研究成功,无疑为口服银屑病治疗领域带来了新的曙光。根据ICONIC-LEAD研究的最新数据,Icotrokinra展现出不俗的治疗潜力,有望成为当前最具竞争力的口服银屑病靶向疗法。
与此同时,其他制药巨头也在积极推动银屑病治疗从注射到口服的迭代。赛诺菲凭借度普利尤单抗在自免领域崭露头角,如今更以口服TNFα抑制剂SAR441566为底牌,剑指自免“王座”。礼来则大力押注口服IL-17小分子抑制剂,尽管经历多次失败,但仍初心不改,持续深耕IL-17开发路径。
在口服IL-17小分子抑制剂的研发上,礼来曾率先推进自研药物LY3509754,但因肝损伤不良反应而止步I期临床。然而,礼来并未因此放弃,而是继续探索并收购了DICE Therapeutics,以获取其两款处于临床阶段的IL-17小分子抑制剂DC-806和DC-853。尽管DC-806因故被放弃,但礼来在IL-17小分子抑制剂领域的布局仍未停止。
随着自身免疫疾病治疗领域的不断深入发展,IL-23R作为关键靶点,将继续吸引更多药企的关注与布局。药企们将通过持续创新、差异化竞争等方式,推动IL-23R药物研发的不断进步,为自身免疫疾病患者带来更多希望与福音。在这场激烈的竞争中,谁将脱颖而出,成为自免领域的领跑者,业界拭目以待。
推荐阅读
强生65亿美元收购的FcRn单抗申报上市
8月29日,强生宣布向FDA提交生物制品许可申请 (BLA),寻求在全球范围内首次批准FcRn单抗nipocalimab用于治疗全身性重症肌无力 (gMG) 患者。
国产新药获批,五雄逐鹿EGFR市场,强生或强势搅局
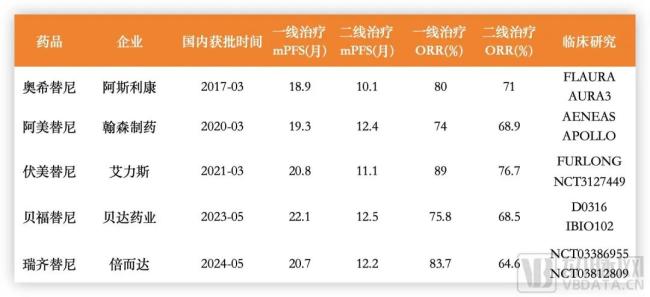
近日,国家药监局官网公示,上海倍而达药业有限公司申报的1类创新药三代EGFR抑制剂甲磺酸瑞齐替尼胶囊(研发代码BPI-7711,商品名:瑞必达)获批上市。
赛诺菲欲出售Opella,GSK、辉瑞、强生……MNC剥离消费者健康业务成风?
在全球化的生物医药行业中,赛诺菲正通过战略调整来应对激烈的市场竞争和融资环境的变化。
BI为何盯上生葆生物?AZ、诺华、强生、赛诺菲、BMS……MNC未来会布局哪些重点领域?
今年上半年,大型跨国药企(MNC)与国内Biotech企业的合作与并购步伐显著加快,其中“抄底”潜力创新资产的趋势尤为明显。
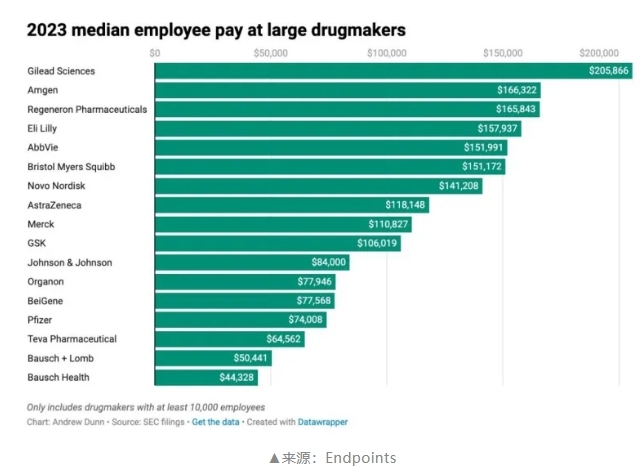
177家美股药企员工薪酬公布!辉瑞下跌,礼来发力,百济、再鼎跻身排行榜!
薪酬中位数超过20万美元的企业,对应医药人共7.2万,仅占177家企业所有员工的5.4%。看来无论在哪个行业,真正能拿到高薪的,永远只是其中很小一部分。
平安好医生9年亏72亿,刚刚扭亏为盈,分红108.5亿港元被指掏空公司
刚刚扭亏为盈的平安好医生开启了巨额分红。行业人士认为,有掏空公司之嫌,不利于未来的发展。