2024年FDA批准的新药
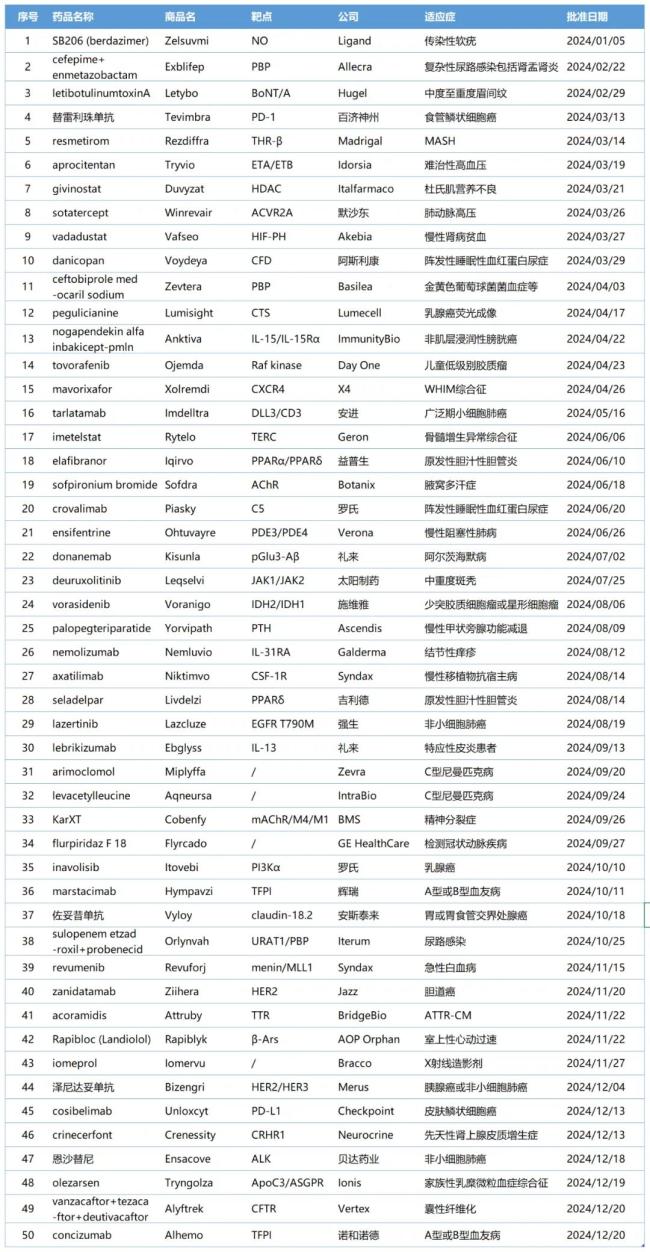
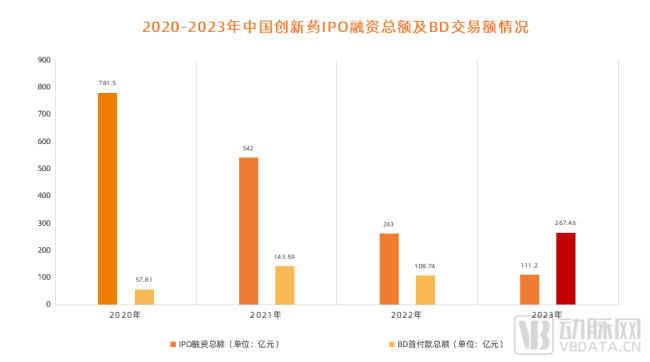
截至目前,2024年美国FDA药品评价与研究中心(CDER)共批准了50款新药,其中包括34款新分子实体和16款生物制品。新分子实体中,小分子居多,占比约达91%(31款),其余包括核酸与多肽类药物;生物制品中,81%为抗体类(10款单抗、3款双抗),其余为融合蛋白及A型肉毒毒素。
注:数据来源于医药魔方数据库及FDA官网(仅限CDER)
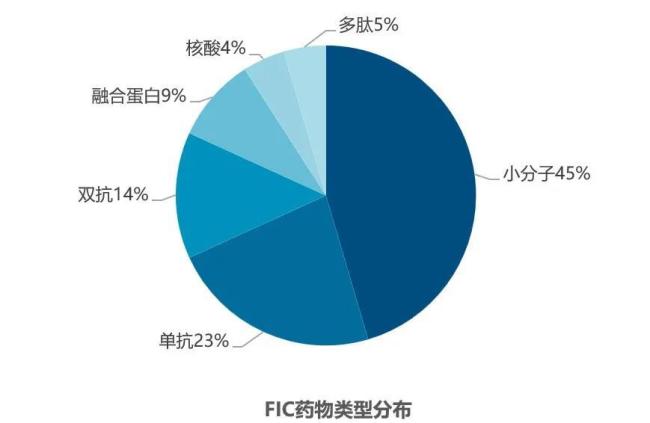
总体而言,2024年CDER批准的新药数量与2023年相差不大,其中“first-in-class”(FIC)药物数量也基本持平。2023年CDER批准了20款FIC药物,占所批准新药数量的36%。而2024年CDER批准的新药中有22款为FIC药物,占比44%。在这些FIC药物中,小分子药物近乎占据了半壁江山(10款),而抗体药物则是另一支创新的主力军(单抗5款,双抗3款)。
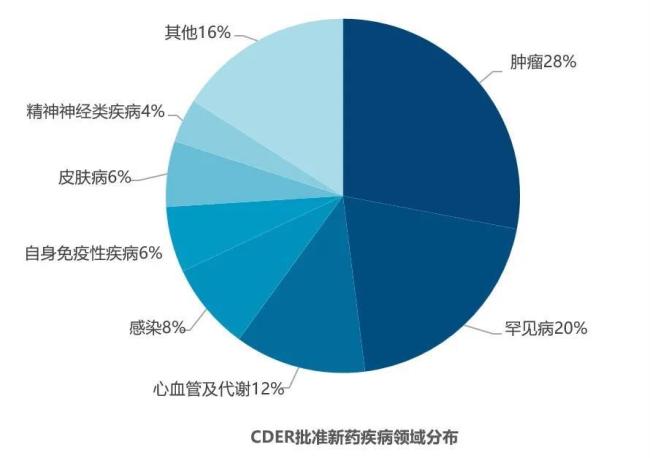
从疾病领域来看,肿瘤(28%)依然是2024年CDER批准新药数量最多的领域,其次是罕见病(20%),之后依次为心血管及代谢、感染、自身免疫性疾病、皮肤病、精神和神经类等疾病领域。
2024年于生物医药领域而言是成果丰硕的一年,CDER批准的多款新药重磅登场,受限于篇幅,我们从中精选了10款独具代表性的新药进行简要回顾。(完整名单请见文末表格)
PD-1单抗:替雷利珠单抗
适应症:食管鳞状细胞癌(ESCC)
3月13日,百济神州的替雷利珠单抗(Tevimbra)获FDA批准,用于治疗既往接受过系统化疗(不含PD-1/L1抑制剂)后不可切除或转移性ESCC的成人患者。这是第二款成功出海美国的国产PD-1,也是百济神州在美国获批的第二款药物。10月14日,该药在美国上市销售,其后续的商业化表现值得期待。
首款THR-β选择性激动剂:Resmetirom适应症:代谢功能障碍相关脂肪性肝炎(MASH)3月14日,Madrigal的口服小分子药物Resmetirom(Rezdiffra)获FDA加速批准上市,用于治疗伴有肝纤维化的非酒精性脂肪性肝炎(NASH,现称为MASH)患者。MASH有着十分庞大的患者群体和临床治疗需求,但由于发病机制复杂,药物研发难度大,始终未能有所突破。Resmetirom是一款甲状腺激素受体(THR)-β口服选择性激动剂,能够调节脂代谢,降低LDL-C、甘油三酯和致动脉粥样硬化性脂蛋白,还可以通过促进脂肪酸的分解和刺激线粒体的生物发生来减少脂肪毒性并改善肝功能,进而减少肝脏脂肪。该药是FDA批准的首款MASH新药。
首款ACVR2A-Fc融合蛋白:Sotatercept
适应症:肺动脉高压(PAH)
3月26日,FDA批准默沙东的Sotatercept(Winrevair)上市,用于治疗PAH。PAH是一种罕见、进行性且危及生命的心血管疾病,此前的PAH疗法可通过促进肺血管扩张来缓解患者病情,但无法从根本上解决肺血管重塑的问题。而靶向ACVR2A的药物是逆转肺血管重塑的潜在有效途径。Sotatercept是由Acceleron Pharma开发的一款FIC的ACVR2A-Fc融合蛋白,可以结合和捕获TGF-β家族配体(TGF-β配体陷阱),恢复肺动脉壁和右心室重构相关的促增殖和抗增殖信号通路之间的平衡,起到抑制细胞增殖、逆转血管重构和畅通血管的效果。2021年9月,默沙东以115亿美元的价格收购Acceleron,获得Sotatercept以及另一款已上市贫血药物Reblozyl。
首款DLL3/CD3双抗:Tarlatamab
适应症:广泛期小细胞肺癌(ES-SCLC)
5月16日,安进的Tarlatamab(Imdelltra)获FDA加速批准上市,用于治疗铂类化疗期间或之后疾病进展的ES-SCLC。该药可激活患者自身的T细胞杀伤表达DLL3的肿瘤细胞,是首款获批上市的靶向DLL3和CD3的T细胞衔接器(TCE)。此前,TCE已在多种恶性血液瘤中展示出了显著效果,且有多款药物成功上市。然而在实体瘤中,这类疗法开发难度较大。Tarlatamab是首个在实体瘤领域取得突破的TCE。
新一代抗Aβ单抗:Donanemab
适应症:阿尔茨海默病(AD)
7月2日,礼来的Donanemab(Kisunla)获FDA批准上市,用于治疗早期症状性AD,包括AD所致的轻度认知障碍以及轻度AD。AD俗称老年性痴呆,是老年期痴呆的常见类型,也是一种神经退行性脑部疾病。Donanemab是一款与β淀粉样蛋白(Aβ)亚型N3pG结合的单抗,能够与AD患者大脑中沉积中的β淀粉样蛋白结合,从而促进患者大脑中淀粉样斑块的清除。该药是继仑卡奈单抗之后的又一款重磅抗AD新药。
全新机制精神分裂症新药:KarXT(呫诺美林+曲司氯铵)
适应症:精神分裂症
9月26日,FDA批准BMS的KarXT(Cobenfy)上市,用于治疗成人精神分裂症。该药是一款复方口服的毒蕈碱类抗精神病药物,由呫诺美林(xanomeline)和曲司氯铵(trospium)组成,其中呫诺美林是M1和M4两种亚型的毒蕈碱乙酰胆碱受体(M-AChR)激动剂,而曲司氯铵则是M-AChR的拮抗剂。这是60年来首次获批的具有全新机制的治疗精神分裂症的药物。2023年12月,BMS以140亿美元收购了Karuna,获得了该药物。KarXT的中国权益归属于再鼎医药。
首款Claudin18.2单抗:佐妥昔单抗
适应症:胃或胃食管交界处腺癌
10月18日,安斯泰来的佐妥昔单抗(Vyloy)获FDA批准上市,用于联合化疗一线治疗局部晚期不可手术或转移性、HER2阴性、Claudin18.2阳性的胃或胃食管交界处腺癌患者。Claudin18.2是一种细胞紧密连接蛋白,在HER2阴性胃癌中,有接近40%的患者高表达该蛋白,是近年来胃癌药物开发的热门靶点。佐妥昔单抗是一款FIC的Claudin18.2单抗,最初由德国Ganymed Pharmaceticals开发,2016年12月,安斯泰来通过收购Ganymed获得了该药物。佐妥昔单抗的问世有望改变胃癌的治疗格局。
首款HER2双表位双抗:泽尼达妥单抗
适应症:胆道癌(BTC)
11月20日,FDA加速批准了Jazz Pharmaceuticals的泽尼达妥单抗(Ziihera)上市,用于治疗既往接受过治疗的不可切除或转移性HER2阳性(HER2+,标准为IHC 3+)BTC成人患者。该药是一种针对HER2两个不同表位的双抗,每个HER2受体可以结合两个泽尼达妥单抗。值得注意的是,泽尼达妥单抗的中国权益归百济神州所有,并且该药也已在中国申报上市,目前正在审评当中。
首款HER2/HER3双抗:Zenocutuzumab
适应症:胰腺癌或非小细胞肺癌(NSCLC)
12月4日,FDA加速批准了Merus的Zenocutuzumab(Bizengri)上市,用于治疗携带神经调节蛋白1(NRG1)基因融合的晚期不可切除或转移性胰腺癌或NSCLC成人患者。NRG1隶属于表皮生长因子家族,通过与表皮生长因子受体(主要是HER3)结合从而激活下游信号通路。Zenocutuzumab是一种双特异性抗体,可与细胞表面表达的HER2和HER3的胞外结构域(包括肿瘤细胞)结合,抑制HER2和HER3二聚化并阻止NRG1与HER3结合从而发挥抗肿瘤作用。这一批准填补了NRG1+癌症患者的重要需求。
ALK抑制剂:恩沙替尼
适应症:NSCLC
12月18日,贝达药业和控股子公司Xcovery共同开发的恩沙替尼获FDA批准上市,用于治疗既往未接受过ALK抑制剂治疗的ALK阳性局部晚期或转移性NSCLC成年患者。ALK是NSCLC重要的致癌驱动因子之一,ALK融合蛋白基因在NSCLC患者中的阳性率为5%左右,且多见于年轻、不吸烟或轻度吸烟的肺腺癌患者。ALK抑制剂能够有效抑制ALK的活性,从而起到抑制肿瘤生长的作用。该药是贝达首个成功出海的产品,也是首个由中国药企主导在全球上市的小分子肺癌靶向创新药。
附表:2024年FDA CDER批准的新药