华网·两会世界窗|波士顿科学:政策创新与本土化共振,看中国医疗产业升级新机遇

文|罗曾
2025年3月4日,随着全国两会进程推进,如何通过制度创新吸引全球资源、激发本土创新活力,成为中国医疗产业高质量发展的关注方向之一。而外企与中国市场的“双向赋能”,或为这一进程注入更多动能。
日前,作为全球医疗科技领域的企业,波士顿科学(Boston Scientific)向中华网财经表示,中国医疗器械审评审批制度改革的持续深化,为跨国企业加速创新产品落地、深化本土化战略提供了强劲助力,其“创新链、价值链、产业链”三链融合的实践或为行业提供参考样本。
据媒体报道,2024年,我国创新医疗器械获批数量持续增长,全年国家药监局共批准65个创新医疗器械产品上市,同比增加6.6%,创下历史新高。而近期《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》的出台,更是进一步释放了国家鼓励研发创新、优化监管效能的信号。
波士顿科学重点提及了中国医疗器械审评审批机制的优化成效:通过真实世界研究试点、创新医疗器械特别审查程序(“创新通道”)及优先审批等政策工具,跨国企业的创新产品进入中国市场的周期显著缩短。以治疗良性前列腺增生的瑞梦(Rezūm)系统为例,借助海南乐城先行区的真实世界数据应用,该产品从试点到获批仅用15个月,较传统路径提前两年半,目前已惠及全国近5000名患者;另一款房颤治疗产品FARAPULSE脉冲电场消融系统,在纳入“创新通道”后,从美国FDA获批到在中国上市间隔不足半年,实现了全球创新成果的“近同步”落地。
波士顿科学认为,审评效率提升与政策支持的协同效应,不仅加速了高端医疗器械的可及性,更推动了产业升级与患者获益的双向提升。
现如今,作为全球医药创新版图中的战略高地,中国已经是全球最活跃的医药市场和制造大国之一。为加快创新产品在中国落地,波士顿科学称,将持续深化本土化进程,多措并举助力创新链、价值链、产业链三链融合。
具体而言:首先通过创新链协同整合,将全球技术优势与中国临床需求深度对接,在产品研发初期,就将中国病患的需求纳入其中,从创新源头缩短引入周期奠定基础;中国区也打造了一支具备软件、数据科学、机械工程、人因工程等跨学科背景的研发团队,更好地发挥本土智慧,提升前沿产品的研发效率;其次,通过价值链循证赋能,构建全生命周期临床价值验证体系,例如通过上市前后的临床研究与国内外的学术交流,增进对创新产品临床价值的验证,坚持以科学严谨、有据可循的方式制定创新产品的临床应用策略,以更好地提升患者获益;最后,通过产业链本土升维,推动高端医疗器械国产化进程,借助医疗器械注册人MAH制度,加快本土生产,目前中国区生产基地的首条生产线也已完成调试,未来将进一步优化本土供应链,实现更及时稳定的产品供应。
推荐阅读
某境外境内公司联手在华非法测绘!特斯拉、极氪等企业紧急辟谣
10月16日晚间,一则涉及威胁国家道路信息安全的新闻登上热搜,短短时间内阅读量、讨论量飙升至千万。
4亿预付款!一条临床前管线卖了
3月3日,日本生物技术公司Kyorin Pharmaceutical(后称“杏林制药”)宣布,与诺华就其发现的临床前阶段管线KRP-M223及其备用化合物达成全球许可协议。
想在2025年实现盈利,再鼎还要跨过几道坎?
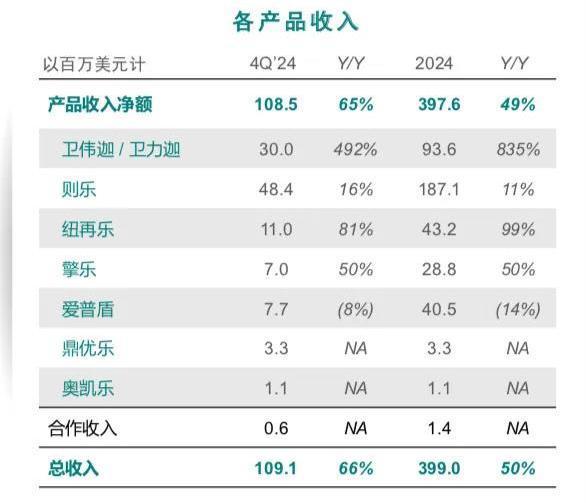
2月27日,再鼎医药发布业绩报告:2024年第四季度销售收入超过1亿美元,全年总收入近4亿美元,分别同比增长66%、50%。
国内领先的互联网慢病处方平台七乐康石榴云医与美年健康达成战略合作,打造涵盖“体检─医疗─医药─医保”的数智化闭环健康管理模式
近日,国内领先的互联网慢病处方平台——七乐康石榴云医与美年健康集团在深圳签署战略合作协议,正式达成战略合作。